|
|
| |
FISIOLOGIA CELLULARE
Compartimenti dei liquidi dell'organismo:
Le cellule degli animali pluricellulari vivono in una sorta di "mare interno", delimitato dal tegumento, il liquido extra-cellulare (LEC). Da esso traggono O2 e nutrienti, ed in esso scaricano le sostanze di scarto. Il LEC si divide in due compartimenti: il liquido interstiziale ed il plasma ematico circolante. Il plasma e gli elementi corpuscolati del sangue formano il volume ematico totale, contenuto nel sistema cardiovascolare. Il liquido interstiziale è quella parte del LEC che si trova fuori del sistema vascolare e che bagna le cellule.
La distribuzione del peso corporeo di un maschio adulto giovane normale è la seguente:
18% proteine
7% minerali
15% lipidi
60% acqua corporea totale (ACT)
40% liquido intracellulare
20% liquido extracellulare
15% liquido interstiziale
5% plasma
Misura dei compartimenti liquidi dell'organismo. In teoria è possibile calcolare il volume di un compartimento liquido dell'organismo tramite il principio della diluizione: si inietta una sostanza a concentrazione nota, si attende che si distribuisca in tutto il compartimento e si calcola la nuova concentrazione, che permette di ricavare il volume desiderato. Si deve tuttavia tenere conto di alcuni fattori critici che rendono più difficili tali misurazioni:
La sostanza iniettata:
non deve essere tossica
deve distribuirsi uniformemente in tutto il compartimento da misurare
non deve influenzare la distribuzione di acqua nel corpo
deve rimanere immodificata o la quantità del cambiamento (metabolismo, escrezione) deve essere nota
deve essere facilmente misurabile
Volume plasmatico.
Il volume plasmatico medio è di circa
Volume del LEC. Il volume del LEC è di difficile misura, poiché i suoi confini sono mal definiti e poche sostanze vi si distribuiscono rapidamente. La linfa non è separabile dal LEC e pertanto con esso viene misurata.
Liquidi transcellulari: sono separati dal LEC, hanno un volume relativamente piccolo ed equilibrano lentamente con esso: sono il liquido cerebro spinale, il liquido sinoviale, i liquidi dell'occhio, i secreti ghiandolari e il contenuto del sistema gastroenterico.
La misura più accurata del LEC si
ottiene utilizzando l'inulina, polisaccaride dal pm di 5200. Generalmente
il LEC rappresenta il 20% del PC (peso corporeo), quindi
Volume del liquido interstiziale. Non può essere misurato direttamente, per la difficoltà di prelevarne dei campioni e perché le sostanze iniettatevi distribuiscono in tutto il plasma. Il suo volume va quindi calcolato sottraendo il volume del plasma da quello di tutto il LEC. Il rapporto LEC/liquido intracellulare è più alto nei bambini, motivo per cui soffrono di più la disidratazione.
Volume del liquido intracellulare. Anche questo volume non può essere calcolato direttamente, ma sottraendo il volume del LEC dall'acqua corporea totale (ACT). L'ACT viene solitamente misurato con il principio della diluizione, utilizzando ossido di deuterio (D2O) - acqua pesante. Il rapporto fra ACT e PC varia con l'età, il sesso, lo stato di nutrizione.
Osmolarità. Se mettiamo in un recipiente due soluzioni saline a diversa concentrazione, separate da una membrana semipermeabile, l'acqua tenderà a spostarsi dal compartimento a concentrazione maggiore al compartimento a concentrazione minore. Tale fenomeno prende il nome di osmosi. Con il termine pressione osmotica, invece, indichiamo la pressione che bisognerebbe esercitare sul compartimento a concentrazione maggiore per impedire tale spostamento di liquido. La pressione osmotica dipende dal numero di particelle in soluzione, e non dal loro tipo, secondo la formula:
P = n R T / V
dove n è il numero delle particelle, R la costante dei gas, T la temperatura assoluta, V il volume.
Se T rimane costante, la pressione osmotica sarà proporzionale al numero di particelle presenti in soluzione.
L'osmole è il peso di una grammomolecola diviso per il numero di particelle mobili liberate da ciascuna molecola in soluzione (ad esempio NaCl si dissocia nei due ioni Na e Cl cosicchè ogni mole in soluzione formerà due osmoli).
La concentrazione osmolale di una sostanza in un liquido è misurata dal grado di diminuzione del del suo punto di congelamento: 1 mole di sostanza riduce il punto di congelamento di 1,86 K.
L'osmolarità è il numero di moli per litro di soluzione, mentre l'osmolalità è il numero di moli per chilo di solvente. L'osmolarità è influenzata dal volume dei soluti e dalla temperatura, l'osmolalità non ne è influenzata. In una soluzione acquosa, il solvente ha una densità pari ad 1, per cui si può indicare l'osmolalità anche come moli/l.
pH. Il pH è il logaritmo negativo della concentrazione di ioni idrogeno presenti in soluzione. Esso deve essere necessariamente mantenuto costante, per il corretto svolgimento dei processi vitali. Il pH fisiologico è di 7,4. Variazioni fra 7,38 e 7,42 si possono considerare normali, variazioni fra 7 e 7,7 sono comunque compatibili con la vita.
Soluzioni tampone. Per mantenere costante il pH, l'organismo ha a disposizione diversi sistemi. Il più veloce è l'utilizzo di soluzioni tampone, ossia di sostanze capaci, all'occorrenza, di legare o liberare ioni H in soluzione. Il sistema tampone più importante nel corpo umano è costituito dall'acido carbonico, il quale si trova parzialmente dissociato in ioni H e bicarbonato
H2CO3 <---------> H + HCO3
Se vengono aggiunti in soluzione ioni H, questi si legano al bicarbonato e formano H2CO3; se vengono aggiunti ioni OH si legano a ioni H, formando acqua, e la sottrazione di ioni H porta ad una maggiore dissociazione di ioni H. Le variazioni di pH vengono così minimizzate.
Composizione ionica del liquido intracellulare ed extracellulare
|
Ione |
Concentrazione (mmol / l H2O) I E |
Potenziale di equilibrio (mV) |
|
Na K Cl |
15 150 150 5,5 9 125 |
+ 60 - 90 - 70 |
La membrana cellulare
Funzioni. Le funzioni della membrana plasmatica sono le seguenti:
1) isolamento fisico. La membrana separa l'interno di una cellula dall'esterno. Si costituisce così una barriera di permeabilità, che consente di mantenere le concentrazioni citoplasmatiche diverse da quelle extracellulari. Le membrane inoltre sono presenti anche all'interno delle cellule, dove dividono lo spazio in compartimenti ed organuli (nucleo, mitocondri, reticolo endoplasmatico, apparato di Golgi)
2) Regolazione degli scambi con l'ambiente (nutrienti, ioni ,prodotti di scarto, prodotti di secrezione)
3) comunicazione fra cellula e ambiente. Contiene recettori specifici per molecole dell'ambiente, sentendo i cambiamenti del liquido extracellulare. L'ambiente influenza così le attività cellulari
4) supporto strutturale. La membrana da sola non dà resistenza meccanica, assicurata invece dal citoscheletro. Tuttavia il citoscheletro si ancora alle proteine di membrana, permettendo di mantenere la forma delle cellule. Inoltre le proteine di membrana hanno anche la funzione di ancorarsi a proteine analoghe delle cellule vicine per assemblare le cellule e formare i tessuti.
Struttura. Il modello a mosaico liquido, proposto da Singer e Nicolson nel 1972, prevede che la membrana sia composta da due strati lipidici, in cui le proteine di membrana si possano muovere tangenzialmente, fatta eccezione per zone rese meno fluide dalla presenza di sfingolipidi e colesterolo. Lo spessore della membrana è di 8 nm e la sua composizione varia a seconda della specie, del tipo cellulare e dell'organulo. Al variare delle condizioni esterne, le cellule cercano di mantenere una fluidità costante, variando la loro composizione.
Composizione. Le membrane cellulari hanno una composizione glicolipoproteica.
I lipidi di membrana sono i fosfolipidi ed il colesterolo. I fosfolipidi sono i componenti principali della membrana plasmatica. Hanno forma di "molletta da bucato", con una testa polare, idrofila, e due code apolari, idrofobe. La porzione idrofilica è composta nella maggior parte dei casi da colina (fosfatidilcoline e sfingomieline), la porzione irofobica è costituita da due acidi grassi, uno saturo ed uno insaturo. Questa morfologia è responsabile della formazione del liposoma, ossia di un doppio strato lipidico con le code idrofobiche affrontate. Il ruolo dei lipidi di membrana è quello di formare una barriera per le sostanze idrosolubili e di fornire un supporto strutturale alle proteine di membrana. Il colesterolo si distribuisce fra gli acidi grassi ed agisce da "tampone di fluidità", in quanto in presenza di sostanze che aumentano la fluidità come gli alcoli e gli anestetici, tende a mantenerla nei valori normali.
I carboidrati sono la componente minoritaria delle membrane e si trovano sul versante extracellulare, legati a proteine o ai lipidi (glicoproteine e glicolipidi). La loro funzione è legata al sistema immunitario, in quanto sono utili marcatori per il riconoscimento cellulare (funzione antigenica).
Le proteine possono essere integrali alla membrana, oppure associate ad essa.
Le proteine di membrana attraversano la membrana più volte (in genere 7 o 12) con i loro domini idrofobici. Le loro funzioni sono principalmente quelle di trasportatori o di mediatori di segnali. Alcune proteine di membrana si spostano all'interno di essa - secondo quanto previsto dal modello a mosaico liquido - altre invece sono fisse e confluiscono polarità alla cellula.
Le proteine associate alla membrana si legano a proteine integrali o a regioni polari di fosfolipidi. A differenza delle proteine integrali possono essere rimosse senza danni per la membrana. I loro ruoli sono di legare il citoscheletro alla membrana e di assolvere funzione enzimatica.
Classificazione e funzione delle proteine di membrana
(1) proteine strutturali
legano la membrana al citoscheletro
formano parte delle giunzioni meccaniche fra cellula e cellula (fondamentali per la muscolatura liscia e cardiaca, che non si inseriscono sui capi ossei; epiteli degli organi cavi per ridurre le sostanze assorbite)
(2) enzimi
catalizzano reazioni sulla superficie esterna della cellula (enterociti, anidrasi carbonica nel tubulo renale)
catalizzano reazioni sulla superficie interna della membrana (trasmissione di segnali)
(3) recettori
sistema di trasmissione dei segnali chimici
specifici per una molecola o un gruppo di molecole affini (endocitosi mediata da recettori, apertura dei canali ligando dipendenti)
(4) trasportatori
canali (formano un corridoio pieno d'acqua fra compartimenti intra ed extra-cellulare, spazio in cui si affacciano le cariche elettriche. Poco selettivo, ma molto rapido)
carrier (non creano una connessione diretta fra spazio intra ed extra-cellulare. Trasporto più selettivo, ma meno rapido)
Canali. Diverse subunità proteiche circondano il canale. Il diametro del canale è limitato, per cui passano acqua, ioni e urea; la velocità di passaggio è di decine di ioni al secondo (ma i canali solitamente stanno aperti per frazioni di secondo). I canali hanno una selettività in base alle dimensioni della molecola ed al tipo di carica elettrica presente sul canale (positiva o negativa). Molti canali sono dotati sul versante citpolasmatico di un cancello, che apre o chiude il canale. In base alla presenza o meno del cancello distinguiamo:
canali di diffusione, sempre aperti
canali a cancello veri e propri. L'apertura del cancello (gate) può essere innescata da diversi fattori, a seconda del tipo di canale:
ligando-dipendente, dove parte della proteina ha funzione recettoriale (es. sinapsi chimiche)
voltaggio-dipendenti, si aprono in seguito a variazioni del potenziale di membrana
meccano-sensibili, si aprono grazie a stimoli meccanici o pressori (recettori del tatto, canali del K nell'organo del Corti)
termo-sensibili, per le percezione della temperatura
Carrier. Più lenti dei canali, agiscono in tre fasi diverse:
la molecola si lega al carrier
il carrier si chiude dal versante extra-cellulare e cambia conformazione
la molecola viene trasportata dal lato opposto della membrana.
Trasportano molecole organiche (glucosio, amminoacidi) e ioni.
Trasporto delle molecole e degli ioni attraverso la membrana cellulare
Si muovono bene molecole piccole e prive di carica elettrica: H2O (per la presenza delle acquaporine), O2 , CO2 e lipidi.
Si muovono meno bene gli ioni, le molecole polari, e le molecole più grandi. Le dimensioni e la solubilità nei lipidi costituiscono un fattore limitante.
I movimenti vengono classificati
a seconda della sede (attraverso lo strato fosfolipidico o con le proteine di membrana)
a seconda delle richiesta di energia (trasporto attivo o passivo)
La diffusione è un processo di trasporto di molecole da un'area a più alta concentrazione ad un'area in cui esse sono presenti in concentrazione minore. Risponde alle seguenti caratteristiche:
è un processo passivo ( non richiede energia)
le molecole seguono un gradiente di concentraizone
ci sarà movimento netto fin quando la concentrazione non sarà uniforme su tutta l'area
la diffusione è rapida a breve distanza, ma diminuisce di velocità con il quadrato della distanza (per tale motivo è preferita negli organismi unicellulari, risultando poco adatta alle funzioni degli organismi pluricellulari)
è direttamente correlata alla temperatura
è inversamente correlata alla dimensione molecolare
può verificarsi in un sitema aperto o attraverso una barriera fra due sistemi (per quanto riguarda la presenza di membrane biologiche, la velocità
dipende dalla capacità della molecola di sciogliersi nello strato lipidico della membrana
è proporzionale all'area della membrana (fondamentale l'area della membrana - vedi alveoli polmonari, intestino)
è inversamente proporzionale allo spessore della membrana
Le regole della diffusione semplice possono essere espresse attraverso la legge di Fick - che non si può applicare a ioni e molecole che non passano liberamente attraverso il doppio strato fosoflipidico:
velocità di diffusione = area superficie * grad. concentrazione / resistenza membrana * spessore membrana
La resistenza di membrana indica il rapporto fra:
resistenza di membrana = solubilità nei lipidi / dimensioni della molecola
Alcune sostanze entrano ed escono dalla cellula grazie alla mediazione di proteine (trasporto mediato). Se il trasporto avviene nel senso di concentrazione e si arresta quando le concentrazioni sono uguali si parla di diffusione facilitata, se è richiesto ATP si parla di trasporto attivo. Le proteine del trasporto mediato sono strutturate allo stesso modo. A seconda del numero di substrati e della direzione in cui vengono trasportati, distinguiamo:
uniporto, quando si trasporta un solo substrato
simporto, quando vengono trasportati due substrati nella stessa direzione,
antiporto, quando vengono trasportati due substrati in direzioni opposte.
Proprietà del trasporto mediato:
1) velocità: è maggiore di quella di molecole con simile peso molecolare e simile solubilità nella membrana lipidica che diffondono semplicemente
2) specificità: viene trasportata una sola molecola o una famiglia di molecole (e per parte di esse ci può essere maggiore affinità)
3) saturazione: la velocità è limitata dal numero di trasportatori
4) competizione: substrati simili concorrono per lo stesso trasportatore (simile all'inibizione competitiva degli enzimi)
5) inibizione: il trasporto può essere inibito da composti simili che si legano al trasportatore, ma non vengono trasportati.
Il trasporto attivo, a differenza della diffusione facilitata, è in grado di trasportare una sostanza contro gradiente. Per fare ciò v'è bisogno di utilizzare energia sotto forma di ATP: quando l'energia deriva direttamente dall'ATP si parla di trasporto attivo primario. Se, invece, l'energia dell'ATP viene accumulata in un gradiente di concentrazione che sarà sfruttato in seguito, si parla di trasporto attivo secondario.
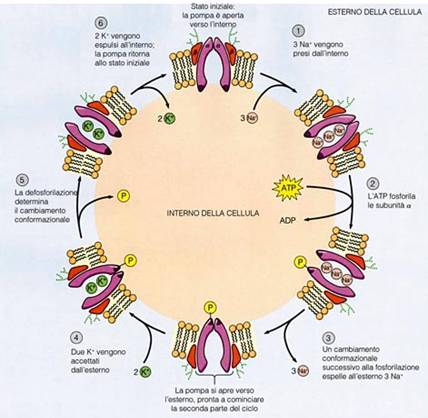
Un esempio di trasporto attivo primario è quello della pompa Na-K ATPasi. Essa utilizza direttamente ATP per trasportare tre ioni Na fuori dalla cellula e due ioni K all'interno, entrambi contro gradiente di concentrazione. La pompa ha un funzionamento ciclico descritto nella figura seguente:
Il trasporto attivo secondario accoppia l'energia cinetica di una molecola che si muove lungo gradiente di concentrazione al movimento di un'altra molecola che si muove contro gradiente. Può avvenire sia in simporto che in antiporto.
Il gradiente usato più spesso è quello generato dalla Na-K ATPasi. Ne è un esempio il trasportatore SGLT 1 e 2, presente nell'intestino e nei reni, che cotrasporta Na - secondo gradiente - e glucosio - contro gradiente.
In alcuni casi la molecola trasportata può evitare di attraversare la membrana grazie alla mediazione di vescicole. Si ha nei casi di macromolecole troppo grandi (sia per il doppio strato lipidico che per canali, carrier e pompe) e nei casi di endocitosi, fagocitosi ed esocitosi.
Pompa sodio potassio e genesi del potenziale di membrana. È possibile analizzare matematicamente le forze che agiscono attraverso la membrana cellulare su ciascuno ione. I Cl, che sono in concentrazione maggiore nel LEC, tendono a diffondere all'interno della cellula, lungo il gradiente di concentrazione. Tuttavia, essendo il potenziale cellulare minore rispetto a quello esterno, gli ioni Cl sono spinti fuori dalla cellula lungo il gradiente elettrico. L'equilibrio viene raggiunto quando nell'unità di tempo la diffusione di Cl verso l'esterno eguaglia quella verso l'interno. Il potenziale di membrana al quale si stabilisce questo equilibrio sarà il potenziale di equilibrio, la cui grandezza può essere calcolata con l'equazione di Nerst, come segue:
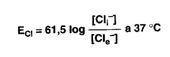
ECl calcolato matematicamente risulta uguale a -70 mV,
valore ottenuto con una misura sperimentale.
Per quanto riguarda il Na e il K la situazione è differente. Nel neurone il K ha un gradiente chimico diretto verso l'esterno e quello elettrico verso l'interno, per un potenziale di membrana riposo di -70 mV. Il suo potenziale di equilibrio è inferiore (-90 mV): questo vuol dire che nel neurone è presente una quantità maggiore di K di quella che può essere spiegata con i gradienti chimico ed elettrico.
La situazione per il Na è differente: il gradiente chimico è verso l'interno, dove la sua concentrazione è minore, ed anche il gradiente elettrico ha lo stesso senso. ENa è di +60 mV. Per cui ci si aspetterebbe che per diffusione Na entri nella cellula e che K ne esca, tuttavia così non accade: le concentrazioni di Na e di K rimangono costanti.
Ciò accade
perché il potenziale di membrana[1]
viene mantenuto dalla pompa sodio potassio, che attivamente trasporta fuori
dalla cellula tre ioni Na, e ne introduce due K. La pompa sodio-potassio
è un eterodimero formato da due subunità, alfa e beta, del peso
molecolare rispettivamente di 100000 e di
La cellula nervosa
Principali caratteristiche di un neurone
tipico. Il neurone è l'unità funzionale
del sistema nervoso. Sebbene i neuroni abbiano caratteristiche differenti,
possiamo riconoscere una struttura di base in comune. Ogni cellula presenta un corpo,
piccolo, contenente nucleo ed organuli (mitocondri, apparato di Golgi, reticolo
endoplasmatico, ribosomi liberi e reg); è la sede delle sintesi
proteiche ed è indispensabile per la vita del neurone: un suo danno
è irreversibile. Dal corpo si dipartono dei processi arborizzati,
chiamati dendriti. Essi aumentano la superficie disponibile per le
sinapsi con gli altri neuroni. Un neurone tipico possiede anche un lungo assone
fibroso, che origina da una regione leggermente ispessita del corpo cellulare,
il monticolo assonico. L'assone si divide in branche terminali, ciascuna
delle quali termina con un certo numero di bottoni sinaptici, ricchi di
mitocondri, e vescicole piene di neurotrasmettitori, neurormoni e neuromodulatori.
I bottoni terminali traggono contatti con vasi sanguigni (secrezione di
neurormoni) e cellule bersaglio (neurotrasmettitori e neuromodulatori).
L'assone dei neuroni mielinici è avvolto da una guaina formata da
cellule della glia, oligodenrdociti all'interno del SNC, cellule di
Schwann al di fuori. Le cellule
della glia formano numerosi avvolgimenti (fino a 100) con la loro membrana
plasmatica attorno all'assone. Grazie alla proteina P0, presente sul versante
extracellulare, le membrane adiacenti si compattano. La guaina mielinica
è assente solo a livello dei nodi di Ranvier, strozzature
periodiche della lunghezza di un micron poste a intervalli di
Da un punto di vista funzionale possiamo distinguere 4 zone nel neurone:
1) una zona recettrice, dove avviene l'integrazione di tutte le variazioni di potenziale prodote dalle connessioni sinaptiche;
2) una sede di origine dei potenziali d'azione propagati, corrispondente al segmento iniziale degli assoni nei motoneuroni spinali e al primo nodo di Ranvier nei nodi sensitivi cutanei;
3) un processo assonico, che trasmette gli impulsi alle terminazioni nervose;
4) una terminazione nervosa, dove i potenziali d'azione causano la liberazione di trasmettitori sinaptici.
A differenza di tutte le altre cellule secernenti, nei neuroni il luogo di secrezione (bottone sinaptico) è molto lontano dal luogo di sintesi (nucleo). Per quanto motivo nei neuroni è presente un vero e proprio sistema di trasporto per le proteine che vengono trasportate fino alle estremità assoniche. L'assone è percorso da filamenti paralleli di tubulina, che funziona da binario per le proteine chinesina, responsabile del trasporto anterogrado di organuli e vescicole secretorie, e dineina, responsabile del trasporto retrogado di vescicole sinaptiche non riciclate e di materiale captato per endocitosi (fattori di crescita e virus). Il trasporto assoplasmatico è un processo che richiede energia (consumo di ATP).
Genesi del potenziale d'azione. La maggior parte delle cellule possiede un potenziale di membrana a riposo. Pur essendo il compartimento intracellulare ed extracellulare globalmente neutri, si crea una d.d.p. fra superficie interna ed esterna della membrana. Sulla superficie esterna della membrana si accumula uno ione positivo, il K; sulla superficie interna si accumulano diversi ioni negativi, Cl e proteine cariche negativamente. Ciò accade perché:
la pompa Na/K è in minima parte anche elettrogenica
la membrana è molto più permeabile ai K (40 volte) che al Na (canali con perdita)
Il valore del potenziale di membrana a riposo varia a seconda del tipo cellulare, nei neuroni è solitamente di -70mV. Se stimolate, le cellule eccitabili (neuroni e cellule muscolari) possono andare incontro a due tipi di variazione del potenziale di membrana:
potenziale graduato
potenziale d'azione
le variazioni del potenziale di membrana si ottengono con il movimento di ioni attraverso la membrana. La membrana aumenta la propria permeabilità ai seguenti ioni:
Na, che entrando causa depolarizzazione
K, che uscendo causa iperpolarizzazione
Cl che entrando causa iperpolarizzazione
il movimento degli ioni è quantitativamente poco rilevante, in modo da ridurre la spesa energetica per ripristinare le condizioni iniziali.
La permeabilità alla membrana può variare in maniera rapida solo grazie a dei canali in grado di aprirsi all'occorrenza. Si tratta dei canali a cancello, che hanno un gate in grado di aprirsi all'occorrenza. Ne esistono di vari tipi, classificati a seconda dello stimolo a cui rispondono:
canali per il Na
voltaggio-dipendenti
chemo-dipendenti
meccano-dipendenti
termo-dipendenti
canali per il K
voltaggio-dipendenti
chemo-dipendenti
canali per il Ca
voltaggio-dipendenti
canali per il Cl
chemo-dipendenti
I canali voltaggio dipendenti possiedono due cancelli: uno di attivazione, che si apre all'arrivo dello stimolo adeguato, ed uno di inattivazione, che chiude il canale dopo circa 0,5 ms.
Il potenziale d'azione è una variazione di potenziale che viene propagata, che costituisce il segnale con cui i neuroni si scambiano informazioni. Si tratta di un segnale stereotipato, sempre uguale, che per modularsi può solo cambiare frequenza. Vediamo come si genera:
la membrana viene sottoposta ad uno stimolo depolarizzante;
la depolarizzazione supera un certo valore (valore soglia, nel neurone di 15 mV circa)
la depolarizzazione aumenta rapidamente, fino a raggiungere il valore isopotenziale
la membrana si polarizza fino ad un valore di 35 mV circa
la membrana si ripolarizza rapidamente
giunto al 70% della ripolarizzazione, la velocità di ripolarizzazione diminuisce
il valore di riposo viene raggiunto e superato di poco (iperpolarizzazione postuma)
anche l'iperpolarizzazione si esaurisce
Il tracciato di un oscilloscopio a raggi catodici ci permette di osservare le variazioni del potenziale di membrana in funzione del tempo. Con due microelettrodi uno all'interno ed uno all'esterno della membrana, si ottiene un simile tracciato
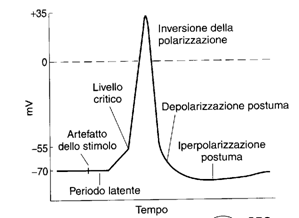
la rapida depolarizzazione e ripolarizzaizione costituiscono il
potenziale a punta, mentre la depolarizzazione più lenta è la
depolarizzazione postuma.
Vediamo adesso quali sono le correnti ioniche responsabili del potenziale d'azione. All'arrivo di uno stimolo sopraliminare (ossia in grado di generare una depolarizzazione al di sopra del valore soglia) si apre un numero critico di canali del Na, che causano una depolarizzazione esplosiva. La polarizzazione non raggiunge il valore di equilibrio del Na, poiché dopo circa 0,5 ms le porte di inattivazione dei canali del Na iniziano a chiudersi e contemporaneamente si aprono le porte di attivazione dei canali del K, causando una depolarizzazione rapida. I canali del K iniziano a chiudersi dopo 1 ms, ma la ripolarizzazione procede arrivando anche a superare il potenziale di riposo, fino a che i canali del K sono tutti chiusi e dopo 5 ms la membrana si riporta al suo potenziale di riposo.
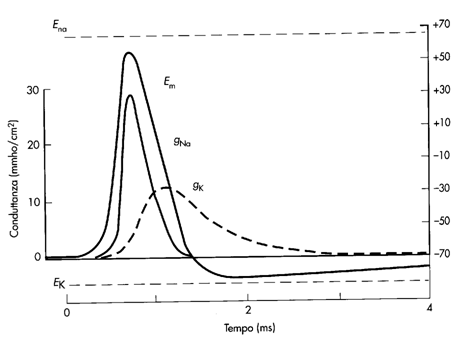
Al funzionamento dei canali voltaggio-dipendenti è legato
il concetto di refrattarietà. Se applichiamo uno stimolo nella frazione
di 1/2500 di secondo dall'applicazione dello stimolo non si ha nessuna
risposta: siamo nel periodo di refrattarietà assoluta. Il periodo
successivo (periodo di refrattarietà relativa) ha una durata da
un quarto alla metà del precedente: durante questa fase si genere un
potenziali d'azione solo se lo stimolo ha un'intensità abbastanza
elevata.
Durante il periodo refrattario assoluto i canali del Na hanno il cancello di attivazione aperto, ma il cancello di inattivazione chiuso, per cui non è possibile generare un potenziale d'azione. Durante il periodo refrattario, alcuni canali sono ritornati alla condizione di partenza, ma altri hanno il cancello di inattivazione ancora chiuso: per questo motivo è necessario uno stimolo di intensità adeguata, per far aprire il numero critico di canali pur disponendo di un numero limitato.
Caratteristiche del potenziale d'azione
Fenomeno tutto o nulla: se applichiamo uno stimolo subliminare non otteniamo alcun potenziale d'azione; se applichiamo uno stimolo durante il periodo refrattario non otteniamo alcun effetto: il potenziale d'azione rimane tale e quale. Per questo motivo viene definito come un fenomeno tutto o nulla, perché o non si genera (stimolo sotto la soglia), o se - viene superato il valore soglia - si genera un potenziale sempre uguale, a prescindere dall'intensità dello stimolo.
Autopropagantesi: la membrana della fibra nervosa è polarizzata a riposo, con cariche positive allineate lungo la superficie esterna e cariche negative allineate lungo la superficie interna. Durante il potenziale d'azione questa polarizzazione è per un breve periodo invertita. Dalle regioni immediatamente avanti e dietro la zona del potenziale d'azione cariche positiva affluiscono nella zona "di ricetto" costituita dalle cariche negative. Tale flusso, togliendo cariche negative, riduce la polarizzazione della membrana. A questo punto inizia una risposta locale che, raggiunto il livello critico, genera un potenziale d'azione e a sua volta genera un potenziale d'azione a valle. Il potenziale d'azione si propaga così sempre uguale a se stesso, mantenendo a distanza la stessa forma e la stessa ampiezza. Il potenziale d'azione non si genera nelle regioni a monte poiché esse si trovano nel periodo refrattario. Anche se si generasse un impulso antidromico, comunque, questo verrebbe fermato dalla barriera anatomica della sinapsi, che permette la trasmissione dello stimolo in un senso solo.
Attivo: anche se nella depolarizzazione sono coinvolti solo trasporti passivi, per ripristinare le condizioni iniziali è necessario l'intervento della pompa sodio/potassio, con dispendio di energia.
Potenziali graduati. Stimolando gli assoni con stimoli subliminari si ottengono comunque delle variazioni del potenziale di membrana. Stimolando l'assone con un catodo si ottiene una depolarizzazione, con un anodo si ottiene iperpolarizzazione; l'ampiezza della risposta decresce esponenzialmente con la distanza. Queste modificazione di potenziale si chiamano potenziali elettrotonici, e più precisamente cataelettrotonici quelli prodotti dal catodo e anaelettrotonici quelli prodotti dall'anodo.
I potenziali anaelettrotonici sono dei fenomeni puramente passivi, per cui la loro ampiezza è proporzionale alla corrente applicata. I potenziali cataelettrotonici superiori a 7 mV sono invece maggiori rispetto a quanto atteso dalla corrente applicata, poiché lo stimolo causa l'apertura di alcuni canali per il Na con conseguente ulteriore depolarizzazione.
Da notare che anche una forte depolarizzazione può causare la genesi di un potenziale d'azione. La cessazione di una corrente anodica infatti può causare un rimbalzo del potenziale di membrana nel senso della depolarizzazione. Se questo rimbalzo è tale da superare il livello soglia si genera un potenziale d'azione.
È necessario comunque che lo stimolo soglia raggiunga la cosiddetta "trigger zone", altrimenti il potenziale d'azione non si innesca ugualmente. La trigger zone corrisponde anatomicamente al monticolo assonico.
Funzioni dei neuroni in un circuito nervoso (????????????)
Meccanismo di conduzione dell'impulso nervoso nelle fibre mieliniche e amieliniche. Come abbiamo già visto, quando lo stimolo raggiunge il cono di emergenza, si aprono i canali voltaggio-dipendenti e si ha una inversione della polarità. Gli ioni Na entrati nell'assone fluiscono nelle zone adiacenti, favorendone la depolarizzazione. Gli ioni Na che si trovano all'esterno della cellula, vicino alla zona con polarità inversa (punto di ricetto), fluiscono verso di essa, favorendo un'ulteriore depolarizzazione. Si generano così continuamente dei potenziali d'azione tutti uguali, fino alla terminazione sinaptica. Dopo l'entrata di Na si aprono i canali del K, che riportano la membrana nelle condizioni iniziali. Il ritardo dell'apertura dei canali del potassio è fondamentale, altrimenti una loro immediata apertura impedirebbe la depolarizzazione. Il potenziale d'azione non si genera a monte, poiché la membrana si trova nel periodo refrattario; a livello del monticolo assonico può generearsi un potenziale antidromico che ha la funzione di "pulire la lavagna" dagli stimoli che hanno generato l'impulso, lasciando spazio a stimoli nuovi. Quella fin qui descritta è una conduzione continua, e riguarda le fibre amieliniche.
Le fibre mieliniche, invece, hanno una propagazione saltatoria. I manicotti di mielina isolano la membrana da flussi ionici, per cui il potenziale d'azione può generarsi solo a livello dei nodi di Ranvier. In questo caso lo ione sodio che si sposta "salta" da un nodo all'altro rendendo la comunicazione più rapida e meno dispendiosa energeticamente (bisogna pompare meno sodio fuori per ristabilire le condizioni iniziali). Questo accade ovviamente se la distanza fra un nodo e l'altro non è troppo elevata.
Velocità di conduzione delle fibre nervose. La velocità di conduzione delle fibre nervose dipende quindi dalla presenza della guaina mielinica: fibre mieliniche possono raggiungere una velocità di conduzione di 120 m/s, mentre le fibre mieliniche arrivano a 2 m/s soltanto. Anche il diametro della fibra è fondamentale per la velocità: la resistenza del citoplasma alla conduzione lungo la fibra si riduce quando il diametro della fibra aumenta.
Classificazione delle fibre nervose. La classificazione di Erlanger e Gasser divide le fibre in base alla loro funzione, al diametro ed alla velocità di conduzione:
|
Tipo di fibre |
funzione |
Diametro (micron) |
Velocità di conduzione |
|
A-alfa |
Propriocezione, innervazione somatica motrice |
12-20 |
70-120 |
|
A-beta |
Tatto, pressione |
5-12 |
30-70 |
|
A-gamma |
Motrici per i fusi neuromuscolari |
3-6 |
15-30 |
|
A-delta |
Dolore, temperatura, tatto |
2-5 |
12-30 |
|
B |
Autonomiche pregangliari |
<3 |
3-15 |
|
C-radici dorsali |
Dolore, temperatura, alcuni meccanocettori, risposte riflesse |
0,4-1,2 |
0,5-2 |
|
C-simpatiche |
Simpatiche postgangliari |
0,3-1,3 |
0,7-2,3 |
Le fibre C sono amieliniche. Come si nota dalla tabella le fibre con il maggiore diametro sono legate alla funzione propriocettiva, tattile e pressoria e con le funzioni motorie somatiche. Le fibre con il diametro minore sono impiegate nella sensibilità dolorifica e termica e nelle funzioni autonomiche. Una nuova classificazione è stata introdotta per le fibre sensoriali, che utilizza numeri romani (da I a IV).
Funzioni della glia. Il sistema nervoso contiene cellule di neuroglia in numero da
microglia, con funzione di cellule spazzine, che assomigliano ai macrofagi tissutali. Probabilmente derivano dal midollo osseo ed entrano nel SNC attraverso i vasi ematici
oligodendrociti, impiegati per la formazione della guaina mielinica all'interno del SNC
astrociti, fibrosi (diffusi nella sostanza bianca) e protoplasmatici (diffusi nella sostanza grigia). Entrambi i tipi inviano prolungamenti ai vasi sanguigni con i quali formano giunzioni strette che formano la barriera emato-encefalica. Producono sostanze trofiche per i neuroni e mantengono costante la concentrazione di ioni del liquido interstiziale, captando K e i neurotrasmettitori glutammato e acido gamma-butirrico.
I recettori
Informazioni sull'ambiente interno ed esterno pervengono al SNC tramite svariati recettori sensoriali, trasduttori che permettono di convertire le varie forme di energia dell'ambiente in potenziali d'azione dei neuroni. Ogni recettore è particolarmente sensibile ad una particolare forma di energia, alla quale risponde con una soglia di energia molto più bassa: questa forma di energia prende il nome di stimolo adeguato. I recettori rispondono anche a forme di energia diverse, ma il loro valore soglia è più alto rispetto a quello dello stimolo adeguato. Quando si raggiunge il valore soglia si genera un potenziale d'azione, che giunge lungo un neurone afferente sensoriale fino al SNC. Se il potenziale d'azione giunge alla corteccia del telencefalo, lo stimolo sarà cosciente, se - viceversa - si ferma nelle aree sottocorticali, lo stimolo sarà incosciente.
I recettori hanno una complessità variabile e vengono divisi in tre classi a seconda della loro struttura:
tipo I: si tratta di terminazioni nevose libere (come quelle di un neurone sensitivo) o incapsulate, come nel caso dei corpuscoli del Pacini, dischi di Merkel, ecc.
tipo II: sono cellule recettoriali specializzate deputate alla conversione dell'energia. Non si tratta di neuroni, ma di cellule epiteliali specializzate che rispondono allo stimolo adeguato rilasciando vescicole di trasmettitori che giungono sui neuroni sensitivi con cui sono in contatto. Ne sono un esempio i bottoni gustativi, le cellule acustiche e vestibolari.
tipo III. Sono i recettori contenuti nella retina. I coni ed i bastoncelli rispondono allo stimolo con potenziali locali, graduati, iperpolarizzanti; anche le cellule bipolari con cui sono in contatto vanno incontro a potenziali locali - iperpolarizzanti o depolarizzanti. Il potenziale d'azione del tipo tutto o nulla, trasmesso a distanze apprezzabili si genera solo a livello delle cellule gangliari.
Tipi di recettori del sistema somatosensitivo. Possiamo distinguere i recettori in base all'energia convertita o alla provenienza dello stimolo. In base all'energia convertita abbiamo cinque tipi di recettori:
1) chemocettori (gusto, olfatto)
2) meccanocettori (tatto, pressione)
3) termocettori
4) fotorecettori (retina)
5) nocicettori: sono i recettori del dolore, che di per sé non è una forma di energia: più rigorosamente bisogna dire che questi recettori sono sensibili a tutto ciò che provoca danno tissutale. Il tessuto danneggiato infatti libera una sostanza, la sostanza P, che si lega a nocicettori determinando la sensazione di dolore. I nocicettori sono presenti sui visceri e sulla cute.
In base al luogo dello stimolo riconosciamo:
1) telerecettori: ambiente esterno lontano (vista)
2) esterocettori: ambiente esterno vicino (temperatura)
3) entercettori: ambiente interno (barocettori della pressione arteriosa)
4) propriocettori: posizione del corpo nello spazio (recettori nelle articolazioni e nei muscoli)
Campi recettivi. Analogamente all'unità motoria, definiamo unità sensoriale un singolo neurone afferente con tutti i suoi rami periferici. Il campo recettivo di una unità sensoriale è l'area dalla quale uno stimolo produce una risposta in quella unità. Generalmente l'area innervata da un'unità si sovrappone e si interdigita con l'area innervata da un'unità limitrofa. Ciò è importante perché all'aumentare dello stimolo vengono stimolati anche recettori di unità differenti: aumenta così il numero delle fibre afferenti attivate e, di conseguenza, il cervello interpreta ciò come un aumento dell'intensità della sensazione. Le zone cutanee innervate da una singola radice spinale prendono il nome di dermatomeri.
Origine del potenziale generatore: l'esempio del corpuscolo di Pacini. Il corpuscolo del Pacini è costituito da numerosi strati connettivali (a cipolla) che avvolgono la terminazione nervosa. La parte terminale del nervo è priva di guaina mielinica; all'interno del corpuscolo si trovano anche una porzione ricoperta da mielina ed il primo nodo di Ranvier. La parte connettivale non ha valore sensoriale: modula la sensazione, ma non interviene nella conversione del segnale. Quando interviene uno stimolo pressorio, si modifica la permeabilità dei canali meccanosensibili del Na, con una conseguente depolarizzazione della membrana (potenziale generatore) e migrazione di cariche (flusso di corrente). La depolarizzazione giunge al primo nodo di Ranvier che viene depolarizzato. Affinché si generi un potenziale d'azione è necessario che venga raggiunta la soglia di attivazione. Una volta raggiunta la soglia di attivazione il potenziale d'azione generato si propaga con i meccanismi noti.
L'intensità degli stimoli viene discriminata in base al potenziale generatore. Se infatti il potenziale d'azione è sempre uguale a se stesso (e quindi indipendente dall'intensità dello stimolo), uno stimolo più intenso causa un'apertura maggiore dei canali del Na, per cui al termine del periodo di refrattarietà il Na depolarizza nuovamente la terminazione nervosa. Aumenta così la frequenza dei potenziali d'azione, finché non si esaurisce il Na entrante. La frequenza dei potenziali d'azione viene interpretata dalla corteccia come una maggiore intensità dello stimolo.
Adattamento. Se ad un recettore viene applicato uno stimolo prolungato ad intensità costante, la frequenza di scarica della fibra nervosa diminuisce progressivamente. Questo fenomeno prende il nome di adattamento o desensibilizzazione. Il grado con cui esso si verifica varia nei vari organi di senso: i recettori per il tatto si adattano rapidamente e sono chiamati recettori fasici. I recettori del seno carotideo, dei fusi neuromuscolari, del freddo, del dolore e di distensione dei pomoni si adattano lentamente ed in modo non completo. Questi sono chiamati recettori tonici. Il mancato adattamento di tali recettori è fondamentale: si tratta infatti di recettori che reagiscono a stimoli potenzialmente nocivi per il nostro organismo, per cui un rapido e completo adattamento vanificherebbe il loro importante compito.
L'adattamento dei corpuscoli di Pacini sembra dovuto all'appiattimento delle lamine connettivali del corpuscolo, che diminuisce la pressione applicata sulla terminazione nervosa. Non si tratta comunque dell'unico meccanismo responsabile della desensibilizzazione, perché si è visto che, rimuovendo le lamine connettivali, si ha ancora un lento declino degli impulsi generati in seguito ad una stimolazione costante.
Trasmissione dell'impulso nervoso: sinapsi
Sinapsi elettriche e sinapsi chimiche
La sinapsi è la regione dove un impulso nervoso si trasmette da una cellula all'altra. Esistono due tipi di sinapsi: sinapsi elettriche e sinapsi chimiche.
Le sinapsi elettriche sono le meno importanti nel sistema nervoso. Esse permettono la trasmissione del potenziale di membrana per flusso diretto di corrente. Le cellule connesse da sinapsi elettriche sono solitamente unite fra loro da gap junctions, all'interno delle quali si trovano file regoalri di molecole proteiche interposte fra le membrane. Queste molecole sono di forma esagonale, con un canale al centro e prendono il nome di connessoni. Ciascuna delle sei subunità è formata da una molecola di connessina (PM 25000). I canali dei connessoni costituiscono le vie di passaggio per gli ioni e si formano grazie al perfetto allineamento di due connessoni delle membrane adiacenti.
Attraverso i canali passano ioni, ATP e messaggeri intracellulari, per cui la comunicazione è sia elettrica che metabolica. La presenza dei canali dei connessoni a bassa resistenza permette la trasmissione bidirezionale degli impulsi, a differenza delle sinapsi chimiche, anche se sono state descritte sinapsi elettriche che conducono in una direzione piuttosto che in un'altra (fenomeno della rettificazione). Le sinapsi elettriche non hanno ritardo sinaptico, per cui sono particolarmente utili nei casi in cui serva una risposta molto rapida. Per le loro caratteristiche sono presenti anche nei tessuti in cui è necessario sincronizzare l'attività cellulare (miocardio, cellule muscolari lisce dell'intestino, cellule epiteliali del cristallino).
Le sinapsi chimiche sono costituite tipicamente da un bottone terminale dell'assone che si pone a contatto con la membrana di una spina dendritica. I due neuroni sono separati da uno spazio di 20-40 nm, occupato da liquido extracellulare, che prende il nome di fessura sinaptica. Il bottone sinaptico è ricco di vescicole di neurotrasmettitore e di mitocondri per la produzione di energia. Per la sua struttura anatomica, la sinapsi chimica è in grado di trasmettere il potenziale d'azione in un'unica direzione.
Vediamo quali sono gli eventi alla base della trasmissione sinaptica:
1) il neurotrasmettitore viene sintetizzato a livello del soma e viene trasportato fino al bottone sinaptico grazie al trasporto assonale rapido.
2) Il potenziale d'azione raggiunge l'elemento presinaptico.
3) I canali del Ca voltaggio-dipendenti a livello del bottone sinaptico si aprono.
4) Ioni Ca entrano.
5) Viene stimolata l'esocitosi delle vescicole.
6) Il neurotrasmettitore, riversato nella fessura sinaptica si muove per semplice diffusione (ciò è la causa del ritardo sinaptico di circa 0,5 ms).
7) Il neurotrasmettitore si lega con i recettori post-sinaptici, che sono canali ligando dipendenti.
8) I canali post-sinaptici si aprono.
9) Si genera un potenziale post-sinaptico eccitatorio o inibitorio (l'apertura dei canali del Na causa il suo ingresso secondo gradiente di concentrazione: depolarizzazione, l'apertura dei canali del K invece causa iperpolarizzazione - il potassio esce secondo gradiente)
10) le vescicole vengono recuperate per endocitosi ed il neurotrasmettitore viene allontanato (ricaptato per endocitosi o eliminato per semplice diffusione)
Il neurotrasmettitore è liberato in "quanti", poiché ogni vescicola contiene una quantità definita di neurotrasmettitore. Ogni "pacchetto" di energia produce un fenomeno elettrico a carico della membrana dell'elemento post-sinaptico. Si generano così una serie di potenziali graduati (e non fenomeni tutto o nulla): più pacchetti si liberano, maggiore è il potenziale.
Organizzazione strutturale della sinapsi neuro-muscolare (placca motrice). Gli assoni che innervano le fibre scheletriche si dividono in numerosi bottoni terminali, uno per una singola fibra scheletrica. La porzione terminale dell'assone è priva di guaina mielinica ed è ricoperta semplicemente da una cellula gliale. I bottoni terminali sono ricchi di vescicole di acetilcolina, il neurotrasmettitore di queste giunzioni. Le terminazioni si adattano in depresssioni della placca motrice, le porzione ispessita della membrana della fibra muscolare che corrisponde alla giunzione.
A questo livello la membrana cellulare presenta delle invaginazioni con recettori per l'acetilcolina che prendono il nome di pliche giunzionali.
Sequenza degli eventi durante la trasmissione
1) apertura dei canali del Ca voltaggio sensibili del bottone
2) esocitosi delle vescicole di acetilcolina e diffusione del neurotrasmettitore
3) legame con i recettori nicotinici nelle pliche giunzionali
4) apertura canali Na e K
5) ingresso di Na (la forza che richiama Na è maggiore della forza che estrude K, a riposo)
6) depolarizzazione: potenziale di placca
A questo punto si crea un ricetto di corrente che depolarizza la membrana adiacente fino al livello critico. Su entrambi i lati della placca si generano potenziali d'azione che si propagano in entrambi i sensi lungo la fibra muscolare. I potenziali d'azione avviano la contrazione muscolare, come sarà descritto più avanti (accoppiamento eccitazione-contrazione). L'acetilcolina presente nella fessura sinaptica viene rimossa dall'acetilcolinesterasi.
Il potenziale di placca viene raggiunto ad ogni eccitazione, poiché il numero di recettori per l'acetilcolina attivato è di 10 volte superiore a quello minimo necessario per produrre un potenziale di placca completo. Ciascun impulso nervoso svuota circa 60 vescicole, contenenti ciascuna 10000 molecole di Ach. Con l'uso del curaro, sostanza che compete con l'acetilcolina, è possibile calcolare il potenziale di placca.
I potenziali di placca in miniatura. A riposo, il bottone terminale libera spontaneamente alcuni quanti di acetilcolina, ciascuno dei quali produce una piccola depolarizzazione (0,5 mV), detta potenziale di placca in miniatura.
Variando la concentrazione di Ca extracellulare, molto meno Ca entra nel terminale nervoso in risposta ad un potenziale d'azione: vengono così liberate meno vescicole di acetilcolina. Questo si traduce in un potenziale di placca la cui ampiezza varia con un andamento a gradini: ogni gradino corrisponde ad un potenziale in miniatura (proprio una vescicola di neurotrasmettitore).
Il riutilizzo delle vescicole. Il ciclo delle vescicole sinaptiche è un processo fondamentale.
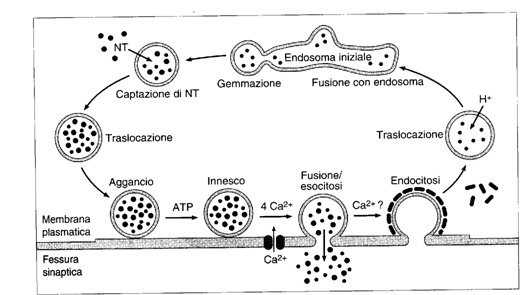
Le vescicole gemmano da endosomi iniziali e poi si riempiono di
neurotrasmettitore. Esse poi si spostano verso la membrana plasmatica dove si
legano grazie ad un complesso di molecole, che comprende la proteina v-snare sinaptopbrevina
della vescicola, la proteina t-snare sintassina della membrana, ed altre
4 molecole. Quando alla terminazione arriva un potenziale d'azione, il Ca
attiva la fusione della vescicola e l'esocitosi. Il Ca viene successivamente
allontanato tramite l'antiporto Ca-Na. La vescicola, la cui parete viene
ricoperta con clatrina, viene in seguito riassunta per endocitosi: nel
citoplasma si fonde con gli endosomi iniziali ed il ciclo è pronto per
riprendere. Durante il riciclo le vescicole sono caricate di neurotrasmettitore
mediante molecole che trasportano lungo gradienti di pH e/o di potenziale (le
vescicole sono hanno una [H] maggiore a causa di pompe protoniche).
L'endocitosi corrisponde quantitativamente all'esocitosi e consente di mantenere costante il volume cellulare.
Le sinapsi en passant
Le fibre post-gangliari del sistema autonomo non hanno strutture sinaptiche specializzate come le placche motrici. I neuroni si ramificano e vengono in stretto contatto con le miocellule (muscolo liscio e cardiaco), corrono lungo la membrana e talora vi si approfondano. Questi neuroni sono caratterizzati da ingrossamenti, noti come varicosità, che non sono coperti da cellule di Schwann e che contengono neurotrasmettitore. Si trovano ad una distanza di circa 5 micron l'uno dall'altro e possono raggiungere il numero di 20.000 per neurone. Sembra che a livello di ogni varicosità si abbia il rilascio di vescicole di neurotrasmettitore: in tal modo un solo neurone può innervare più cellule effettrici. Una sinapsi del genere, dove un neurone è a contatto con una cellula effettrice e poi passa a stabilire contatti con altre cellule prende il nome di sinapsi en passant.
Le sinapsi chimiche con proprietà integrative
Le proprietà generali delle sinapsi chimiche sono state descritte in precedenza. Qui ricordiamo che a livello della sinapsi chimica non si generano potenziali d'azione, ma potenziali graduati, che possono eccitare o inibire l'elemento post-sinaptico.
Nelle giunzioni del tipo uno-a-uno come le placche neuromuscolari un potenziale d'azione sull'elemento presinaptico produce automaticamente un un potenziale d'azione sull'elemento post-sinaptico, per cui non vi è alcun tipo di integrazione.
Nelle giunzioni molti-a-uno, come le sinapsi chimiche fra neuroni, un solo potenziale d'azione sull'elemento presinaptico non è sufficiente a generare un potenziale d'azione sull'elemento postsinaptico. Un potenziale d'azione isolato produce una variazione del potenziale post-sinaptico nell'ordine di 1-2 mV.
Si tratta di un potenziale graduato, che ha le seguenti caratteristiche:
la sua ampiezza è proporzionale al numero di quanti liberati dall'elemento presinaptico (fenomeno graduato)
l'ampiezza diminuisce esponenzialmente con la distanza (fenomeno decrementale)
è localizzato nel punto in cui si verifica l'ingresso dello ione (fenomeno locale)
può essere depolarizzante o iperpolarizzante
Il potenziale post-sinaptico eccitatorio (EPSP) è provocato da un incremento transitorio della conduttanza della membrana postsinaptica sia al Na che al K in risposta al neurotrasmettitore. Al valore del potenziale di riposo della membrana, la forza che spinge il Na ad entrare è superiore alla forza netta che spinge il K ad uscire, per cui si verifica un flusso netto di Na verso l'interno della cellula, con conseguente depolarizazione.
Il potenziale post-sinaptico inibitorio (IPSP) è causato da un'aumentata conduttanza al Cl in risposta al neurotrasmettitore. In condizioni di riposo il Cl tenderebbe ad entrare nella cellula, per cui l'aumentata conduttanza causa un ingresso netto di ioni con conseguente iperpolarizzazione della cellula.
L'integrazione (o sommazione) degli input sinaptici può avvenire per sommazione spaziale o temporale. Si ha una sommazione spaziale quando due input arrivano alla cellula postsinaptica contemporaneamente. Due potenziali postsinaptici si possono sommare, tanto che due input eccitatori simultanei provocano nella cellula postsinaptica una depolarizzazione circa doppia rispetto a quella provocata da un solo input. Tuttavia, se un input è eccitatorio e l'altro è inibitorio, essi tendono ad annullarsi fra loro. Si ha sommazione temporale quando un neurone presinaptico invia due o più potenziali d'azione in rapida successione, in modo che i potenziali postsinaptici possano sommarsi nel tempo. Un treno di impulsi in un singolo neurone presinaptico può provocare nella cellula postsinaptica una depolarizzazione a gradini, essendo ogni gradino provocato da un singolo impulso presinaptico.
Generazione del potenziale d'azione nel neurone postsinaptico
La continua interazione fra attività eccitatorie ed inibitorie che ha sede sulla membrana postsinaptica induce delle fluttuazioni del potenziale di membrana. Il potenziale di membrana rappresenta la somma algebrica degli input ricevuti: quando tale somma algebrica raggiunge il valore di -55mV si genera un potenziale d'azione che viene propagato. Il luogo dove si genera il potenziale d'azione è la zona trigger, corrispondente al monticolo assonico anatomico, dove la cellula ha la soglia più bassa per generare il potenziale d'azione (-55 mV, appunto). Questo segmento amielinico è influenzato dall'attività elettrotonica dei "ricetti" o delle "fonti" di corrente che si formano sotto i bottoni sinaptici, rispettivamente depolarizzanti ed iperpolarizzanti. La zona trigger è la prima che scarica, e da qui il potenziale d'azione si propaga nei due sensi: ortodromicamente lungo l'assone ed antidromicamente al soma. La propagazione antidromica ha la funzione di "ripulire la lavagna" lasciando spazio nel soma agli stimoli nuovi.
La modulazione della trasmissione sinaptica
Inibizione post-sinaptica. Rapida nell'instaurarsi e nello scomparire,può essere di due tipi:
diretta, in cui un PPSI allontana il neurone dal valore soglia. È il caso dell'inibizione golgiana: le fibre afferenti di un fuso neuromuscolare producono PPSE sul motoneurone che innerva lo stesso muscolo, ma anche - tramite delle fibre collaterali - stimolano un neurone a bottiglia del Golgi che produce dei PPSI a livello dei motoneuroni dei muscoli antagonisti.
indiretta, dovuta agli effetti di una precedente scarica del neurone postsinaptico. È il caso di un neurone che ha appena scaricato e si trova nel suo periodo refrattario o talvolta anche nel periodo di iperpolarizzazione postuma (sopratutto se la scarica precedente è stata ripetuta, il neurone è meno eccitabile)
Inibizione pre-sinaptica. Più lenta nello sviluppo (molti ms) e di durata maggiore (minuti/ore) è un processo mediato da neuroni che giungono su terminazioni eccitatorie, formando sinapsi asso-assoniche. Può agire su una sola ramificazione dell'assone terminale.
Finora sono stati descritti tre tipi di meccanismi per questa inibizione:
il neurone inibitorio libera GABA, che agendo tramite il recettore GABA-A aumenta la permeabilità per il Cl a livello della terminazione presinaptica. L'ingresso di Cl diminuisce l'ampiezza del potenziale d'azione che giunge a livello della terminazione presinaptica. La quantità di Ca che entra si riduce e di conseguenza anche la quantità di neurotrasmettitore liberato
il neurone inibitorio libera GABA, che agendo tramite il recettore GABA-B aumenta la permeabilità per il K a livello della terminazione presinaptica. L'uscita di K diminuisce l'ampiezza del potenziale d'azione che giunge a livello della terminazione presinaptica. La quantità di Ca che entra si riduce e di conseguenza anche la quantità di neurotrasmettitore liberato
vi è anche un altro meccanismo Ca-indipendente che riguarda l'inibizione diretta della liberazione del trasmettitore.
Facilitazione presinaptica. Quando un neurone viene stimolato ripetutamente, la risposta postsinaptica può aumentare progressivamente con ogni stimolo. Questo fenomeno prende il nome di facilitazione post-sinaptica e si esaurisce in frazioni di secondo. Quando un neurone viene stimolato tetanicamente si ha un fenomeno simile, che prende il nome di potenziamento post-tetanico, che ha una durata di gran lunga superiore (decine di minuti, ore). La stimolazione prolungata fa aumentare il contenuto di Ca intracellulare; inoltre pare che intervenga anche il neurotrasmettitore serotonina, che - liberato sulle sinapsi asso-assoniche - fa aumentare l'AMPc intraneuronale, con conseguente fosforilazione e chiusura dei canali del K. Tutto ciò causa una più lenta ripolarizzazione e la liberazione di una maggior quantità di mediatore chimico.
Inibizioni feed-back e feed-forward. I neuroni possono auto-inibirsi con un meccanismo di feed-back negativo. I motoneuroni spinali ad esempio emettono regolarmente collaterali ricorrenti che vanno ad interneuroni inibitori che a loro volta si portano sul soma dello stesso motoneurone spinale e lo inibiscono. Tali interneuroni prendono il nome di cellule di Renshaw. Il meccanismo di feeed-back impedisce la persistenza dello stesso segnale. Inibizioni di questo genere si trovano anche nel sistema limbico e nella corteccia cerebrale.
A livello del cervelletto è noto un altro tipo di inibizione, che prende il nome di feed-forward. Le cellule dei canestri vanno ad inibire le cellule di Purkinje. La stimolazione delle cellule dei canestri è dovuta a fibre collaterali delle stesse fibre afferenti delle cellule di Purkinje. Tale inibizione quindi "porta avanti il segnale", limitando presumibilmente la durata dovuta alla scarica eccitatoria afferente.
Disegna
Facilitazione, occlusione, frangia subliminare
Consideriamo la rete neuronale in figura.
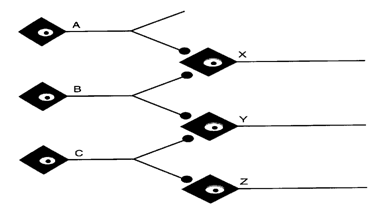
Il neurone C scarica su Y e Z, ma il potenziale d'azione non si
genera nell'elemento post-sinaptico. Se anche B scarica, trova Y con
un'eccitabilità aumentata (facilitazione o sommazione),
per cui si ha una sommazione spaziale dei due PPSE e il potenziale d'azione
può essere raggiunto. Se A e B scaricano, X scarica, mentre Y non
scarica. L'eccitabilità di Y aumenta comunque, per cui sarà
più facile per il neurone C eccitarlo. Si dice dunque che Y è
nella frangia subliminare di X.
Se B viene stimolato ripetutamente, X e Y scaricheranno per effetto della sommazione temporale. Se viene stimolato C, scaricheranno Y e Z. Se B e C vengono stimolati ripetutamente e contemporaneamente, scaricheranno X, Y e Z. Tuttavia la risposta alla stimolazione simultanea di B e C non sarà uguale alla somma delle risposte alle singole stimolazioni di B e C. Ciò accade perché sia B che C scaricano su Y. Quando neuroni presinaptici differenti scaricano sullo stesso neurone postsinaptico non è sempre possibile sommare gli output (non si può superare una frequenza massima): questo fenomeno prendo il nome di occlusione.
I neurotrasmettitori
Definizione. Un ipotetico trasmettitore, prima di essere accettato come trasmettitore certo di una determinata sinapsi, deve soddisfare i seguenti requisiti:
il neurone presinaptico deve contenerlo in vescicole e deve essere in grado di sintetizzarlo
deve essere liberato dal neurone presinaptico in seguito a stimolazione adeguata
deve avere recettori specifici sull'elemento postsinaptico: l'applicazione di microdosi di trasmettitore deve riprodurre gli effetti della stimolazione presinaptica
Neurotrasmettitori a piccola molecola. Hanno azione rapida e sono usati per la trasmissione rapida di segnali di sensibilità e segnali motori ai muscoli. Ne fanno parte:
acetilcolina, il neurotrasmettitore usato da tutti gli assoni motori che originano dal midollo spinale
amminoacidi: glutammato e aspartato, aminoacidi dicarbossilici che hanno un potente effetto eccitatorio su neuroni cerebrali; GABA, ottenuto per decarbossilazione dal glutammato, è il neurotrasmettitore più diffuso nel cervello ed ha effetto inibitorio, la glicina, il più semplice degli amminoacidi, è un trasmettitore inibitorio a livello di alcuni interneuroni spinali.
Amine biogene: adrenalina, noradrenalina, dopamina, ottenute dall'amminoacido tirosina; serotonina, ottenuta per idrossilazione e decarbossilazione del triptofano; istamina, ottenuta per decarbossilazione dall'istidina.
Purine: adenosina (inibitore) ATP
Neuropeptidi: sono
peptidi (da
Esempi di neuropeptidi sono la metencefalina, le alfa e beta endorfine, la sostanza P

Ciclo di vita di un neurotrasmettitore e rimozione del segnale.
I neuropeptidi possono essere sintetizzati solo nel soma, dove seguono l'iter
delle proteine secretorie: sintetizzati a livello del REG, vengono smistati
dall'apparato di Golgi, si staccano per gemmazione sotto forma di vescicole e
raggiungono tramite trasporto assonale il terminale sinaptico. I
neurotrasmettitori a piccola molecola, invece, sono sintetizzati anche a
livello del bottone sinaptico da enzimi idrosolubili.
La rimozione del segnale avviene con tre meccanismi diversi:
diffusione nello spazio circostante
riassorbimento nelle terminazioni nervose (o nelle cellule gliali)
degradazione da enzimi presenti sulla membrana dell'elemento pre o post sinaptico
I neuropeptidi non possono essere riassorbiti da parte dell'elemento presinaptico a causa delle loro notevoli dimensioni molecolari.
Trasporto assoplasmatico. Il trasporto assoplasmatico anterogrado può essere rapido (400mm/d)
o lento (0,5-10 mm/d). Entrambi i trasporti coinvolgono la tubulina, molecola filamentosa che si trova all'interno dell'assone. Il trasporto anterogrado rapido è mediato dalla proteina kinesina. La kinesina si attacca alla vescicola e con i suoi due "piedi" cammina sul "binario" di tubulina fino al bottone. Ogni piede idrolizza ATP, producendo un cambiamento conformazionale, che fa avanzare la proteina di circa 5-10 nm. I tempi di questi processi sono perfettamente compatibili con quelli fisiologici. Esistono numerosi altri motori molecolari, e sembra che vi siano diversi motori a seconda del contenuto vescicolare.
La dienina è la molecola proteica responsabile del trasporto retrogrado, con una velocità 200 mm/d.
Recettori dei neurotrasmettitori. I recettori sono presenti sia sul terminale presinaptico che su quello postsinaptico; legando il neurotrasmettitore, essi:
aprono e chiudono canali ionici, causando depolarizzazione o iperpolarizzazione
modificano le sintesi proteiche della cellula (produzione di neurotrasmettitore e canali ionici)
modificano il metabolismo della cellula (::::::::::::?:::::::::::::::)
I recettori possono essere di due tipi: ionotropi e metabotropi.
I recettori ionotropi sono semplicemente dei canali ionici ligando dipendenti, per cui all'arrivo del neurotrasmettitore il canale si apre e la membrana si depolarizza o iperpolarizza.
Alcuni recettori metabotropi sono proteine di membrana che attivano un sistema di comunicazione intracellulare che attiva una cascata di reazioni che porta all'apertura dei canali ionici. È l'esempio dei recettori metabotropi a serpentina associati a proteine G che fanno aumentare la concentrazione intracellulare di IP3 e DAG. La complessità di questo tipo di recettori è funzionale all'amplificazione del segnale. I recettori dei neuropeptidi sono in genere metabotropi: in ciò risiede la risposta maggiore ai neuropeptidi.
Altri recettori modulano le sintesi proteiche (es. attivazione dell'adenilato ciclasi--> fosforilazione di proteine--> comunicazione al nucleo per attivare l'espressione genica--> produzione di canali, es. per l'acetilcolina. Le sinapsi non servono solo alla depolarizzazione).
Comunicazioni intracellulari
Metodi di comunicazione
1) trasferimento citoplasmatico diretto: tramite giunzioni comunicanti, si scambiano segnali chimici ed elettrici
2) segnali dipendenti dal contatto fra cellule: importanti nello sviluppo embrionale e nella risposta immunitaria
3) comunicazione chimica locale: utilizzo di neuromodulatori, sostanze autocrine o paracrine
4) comunicazione a lunga distanza: combinazione di segnali elettrici e/o chimici veicolati dai sistemi nervoso ed endocrino
Trasferimento citoplasmatico diretto. In corrispondenza delle gap junctions si ha pasaggio di ioni e piccole molecole, quali AMPc, GMPc e amminoacidi. Questo provoca la formazione di veri e propri sincizi funzionali dove sono presenti le gap junctions: nel muscolo cardiaco e nel muscolo liscio.
Segnali dipendenti dal contatto fra cellule. La comunicazione sfrutta proteine di membrana di cellule adiacenti, che prendono il nome di CAM (cell adhesion molecules). Molte sono proteine integrali ed ancorate al citoscheletro. Mediano l'adesione fra cellule e sono fondamentali durante lo sviluppo embrionale (soprattutto del S.N.) e per la risposta immunitaria. Il contatto con le altre cellule impedisce la proliferazione (questo meccanismo manca in caso di tumore), le cellule che perdono il contatto con le CAM hanno invece una frequenza di apoptosi più alta.
Comunicazione chimica locale. La cellula libera una sostanza che agisce sulla stessa cellula (secrezione autocrina) e/o sulle cellule circostanti (secrezione paracrina). Un esempio di sostanza a secrezione autocrina sono le citochine. Si tratta di un gruppo di peptidi regolatori, secreti in risposta ad uno stimolo da tutte le cellule nucleate. Modulano le risposte di difesa dell'organismo (stress-infiammazione) e controllano lo sviluppo e la differenziazione cellulare (cellule indifferenziate delle mucose, cellule satelliti della muscolatura). Si muovono per via autocrina e paracrina, ma anche attraverso il circolo sanguigno (tuttavia non si tratta di ormoni: non sono sintetizzate da cellule specializzate, hanno un ampio spettro di cellule bersaglio e sono sintetizzate a richiesta).
Comunicazione a distanza. Avviene tramite i sistemi:
endocrino: vengono utilizzati dei segnali chimici (ormoni), immessi in circolo, che arrivano a tutte le cellule, ma agiscono solo su cellule dotate di recettori specifici (il trasporto aspecifico del circolo è reso specifico)
nervoso: vengono utilizzati segnali elettrici e chimici. Il potenziale d'azione (segnale elettrico) a livello della sinapsi viene trasformato in segnale chimico e viceversa
neuroendocrino: vengono utilizzati segnali elettrici e chimici: i neuroni dei nuclei paraventricolare e sovraottico vengono stimolati da potenziali d'azione (segnali elettrici) a produrre il neuro-ormone. Questo viene secreto ed entra nel circolo ematico (segnale chimico).
Recettori di membrana. Le sostanze autocrine e paracrine non vengono rilasciate in modo specifico sulle cellule bersaglio, però agiscono in modo specifico solo su alcune cellule; inoltre alcune cellule possono rispondere in maniera diversa alla stessa sostanza. Ciò è possibile grazie ai recettori di membrana che si trovano sulla superficie cellulare. Una stessa cellula può avere più recettori per la stessa sostanza; la risposta dipende più dal recettore che dalla sostanza stessa: ad esempio l'adrenalina ha un effetto vasocostrittore o vasodilatatore sulla muscolatura liscia a seconda della presenza di recettori alfa o recettori beta.
Si dicono agonisti le molecole (farmacologiche) che si legano ai recettori di una determinata sostanza e ne prolungano o intensificano l'azione. Gli antagonisti sono invece molecole che, legandosi al recettore di una sostanza endogena, impediscono ad essa di agire.
Le risposta ad una molecola può essere modulata con fenomeni di up e down regulation dei recettori, in modo da mantenere la risposta costante. Si osserva sperimentalmente che i recettori possono cambiare di numero in seguito al tipo di stimolazione che ricevono: se vi è tanto stimolo, il numero dei recettori diminuisce (down regulation), se vi è poco stimolo il numero dei recettori aumenta (up regulation). Ricordiamo inoltre che mutazioni della sequenza amminoacidica possono far variare l'affinità per il ligando, come ad esempio nel diabete di tipo II, non insulino-dipendente.
I recettori di membrana possono essere divisi in classi:
1) ionotropi: il recettore è un canale di membrana che viene aperto o chiuso dallo stimolo adeguato
2) metabotropi: sono di due tipi. Il recettore può avere una regione con funzione recettoriale ed una con funzione enzimatica ed attivare un enzima intracellulare, oppure può essere accoppiato ad una proteina G che apre un canale ionico o modifica l'attività di un enzimatica
3) integrine: si tratta di recettori ancorati al citoscheletro tramite proteine di ancoraggio. Il legame del ligando alle integrine modifica il citoscheletro. Sono molto importanti durante lo sviluppo dei tessuti.
Primi e secondi messaggeri: il sistema della tirosin chinasi e delle proteine G. I primi messaggeri non sono altro che le molecole segnale. Si distinguono, a seconda della loro natura chimica, in lipofili e lipofobici. I messaggeri lipofili sono gli ormoni steroidei, che hanno recettori nel citoplasma e nel nucleo. I messaggeri lipofobici, non potendo attraversare la membrana plasmatica, hanno dei recettori di membrana, ionotropi o metabotropi.
La trasduzione del segnale avviene tramite due sistemi: le tirosinchiansi e le proteine G.
I recettori ad attività specifica per la tirosina sono delle proteine costituite da una porzione recettoriale, extracellulare, ed un dominio intracellulare che possiede attività proteina chinasica specifica per la tirosina. I recettori di questo tipo sono quelli dei fattori di crescita, delle citochine e dell'insulina. Prendiamo ad esempio il recettore per l'insulina. Quando l'insulina si lega al dominio alfa del suo recettore, il dominio beta intracellulare si autofosforila e poi fosforila la proteina bersaglio IRS1, a livello di un residuo di Tyr. IRS1 attiva una sequenza di interazioni proteina-proteina che portano ad attivare la proteina RAS. A sua volta RAS genera una cascata di proteina chinasi che termina con la fosforilazione di proteine bersaglio nel nucleo. Queste ultime si uniscono fra loro per stimolare la trascrizione di geni particolari.
I recettori accoppiati alle proteine G funzionano in sinergia con proteine che legano il GTP ed enzimi che producono il secondo messaggero. Vediamo alcuni esempi di funzionamento.
I recettori beta adrenenergici di fegato,
muscolo e tessuto adiposo sono costituiti da un recettore a serpentina
accoppiato ad una proteina G. Quando l'adrenalina si lega al suo recettore, il
GDP che si trova legato alla subunità alfa del recettore viene scambiato
con GTP. G-alfa si stacca quindi dalle subunità beta e gamma e diffonde
attraverso la membrana. G-alfa si lega quindi all'adenilato-ciclasi, l'enzima
che produce il secondo messaggero, l'AMPc. L'AMPc attiva una proteina
citosolica, la proteina chinasi A.
fig
Un altro esempio è quello dei recettori
accoppiati alla fosfolipasi C. Quando un ormone si lega a questo tipo di
recettore si ha l'attivazione - come nel caso precedente - di una proteina G.
G-alfa attiva la fosfolipasi C, che catalizza la produzione di due potenti
secondi messaggeri: diacilglicerolo e inositolo 1,4,5 trifosfato. L'IP3
si lega a specifici canali del Ca del reticolo endoplasmatico e ne permette
l'ingresso nel citosol. Ca e DAG attivano la proteina chinasi C, presente sulla
superficie citoplasmatica della membrana.
fig
I recettori descritti finora sono recettori metabotropi; esistono anche recettori ionotropi che legano messaggeri lipofobici. I loro meccanismi di azione sono molteplici: talvolta sono accoppiati direttamente con proteine G, altri canali rispondono invece a secondi messaggeri intracellulari.
Secondi messaggeri:
1) AMPc
2) GMPc
3) DAG
4) IP3
5) ioni: Na, K, Ca
Enzimi amplificatori:
Muscolo scheletrico
Morfologia funzionale
La funzione del muscolo scheletrico è quella di permettere il movimento (volontario ed involontario) e di mantenere la postura. Tali attività vengono eseguite grazie a contrazioni isometriche o isotoniche, in cui si ha sviluppo di forza o accorciamento delle fibra muscolare.
I capi muscolari sono inseriti a valle e a monte di un'articolazione (ovviamente non sullo stesso segmento osseo) tramite tendini. Nella parte carnosa sono presenti delle membrane connettivali: l'epipmisio, che avvolge esternamente il muscolo, il perimisio, che avvolge i fascicoli, e l'endomisio, che avvolge ciascuna fibra. Queste strutture si continuano con i tendini.
La fibrocellula muscolare scheletrica tipica
è una cellula cilindrica allungata, polinucleata. Si tratta di sincizi
molto lunghi (fino a
Le miofibrille hanno un diametro di circa un micron e sono avvolte ognuna dal reticolo sarcoplasmatico. Le cisterne del reticolo sarcoplasmatico (o sarcolemma) sono in rapporto con i tubuli T, invaginazioni della membrana plasmatica che aumentano la superficie di contatto con il LEC. Due cisterne terminali si dispongono ai lati di ciascun tubulo T, fra la banda A e la banda I, formando le cosiddette triadi. Nelle fibrocellule muscolari scheletriche sono presenti numerosi mitocondri per la produzione di ATP e i nuclei sono siti in posizione ipolemmale.
All'esame al microscopio ottico, la fibra muscolare a riposo mostra una tipica striatura di bande chiare e bande scure. Un osservazione ad ingrandimento superiore con il microscopio elettronico mostra l'organizzazione particolare della cellula:
oltre alle bande A, scure (anisotrope)
e alle bande I, chiare, (isotrope),
distinguiamo:
una banda H più chiara, all'interno delle bande A;
una linea M al centro della banda A
una linea Z al centro della banda I
L'area compresa fra due linee Z adiacenti prende il nome di sarcomero e rappresenta l'unità strutturale e funzionale della fibra scheletrica.
La caratteristica striatura di queste cellule è dovuta alla presenza di due tipi di filamenti, che hanno diverso diametro: la banda A è costituita da fibre dal diametro maggiore, la banda I è costituita da fibre con un diametro minore. I due tipi di fibre si interdigitano a livello della banda A; la banda H è quella parte della banda A dove sono presenti solo filamenti spessi. Filamenti sottili e spessi si trovano interdigitati fra loro in modo che ogni filamento spesso risulta al centro di un esagono al cui vertice si trovano sei filamento sottili ed ogni fialemtno sottile si trova al centro di un triangolo costituito da filamenti spessi. Le linee M e Z sono dovute alla presenza di proteine del citoscheletro che tengono uniti rispettivamente i filamenti spessi e sottili.
Proteine contrattili
Miosina: si aggrega per formare i filamenti spessi. Si tratta di un esamero formato da 2 polipeptidi a catena pesante e 4 polipeptidi a catena leggera. Le due catene pesanti sono organizzate in una porzione ad alfa elica, attorcigliate fra loro in una superelica, ed in una porzione globulare terziaria, la "testa", che sporge ad un'estremità della catena pesante. Le due "teste" sono orientate in maniera opposta fra loro. Le catene leggere sono di due tipi, alcaline (estraibili con soluzioni basiche) e regolatorie (perché fosforilabili). Le molecole di miosina si aggregano fra loro a formare i filamenti spessi. Le molecole si dispongono con le loro code attorno a filamenti di titina, che funge da stampo. Lateralmente proiettano le teste, che formano i ponti trasversali, in quanto possono unire tra loro filamenti spessi e sottili contigui. I ponti sono disposti ad una distanza fissa fra loro e si trovano disassati di 120° con i ponti adiacenti. La parte centrale del filamento spesso è priva di ponti.
La miosina è il "motore" della contrazione in quanto consuma l'ATP necessario alla "macchina" sarcomero. Le sue funzioni sono tre:
1) aggregazione con altre code di miosina
2) aggregazione con actina
3) attività ATPasica di una porzione di aa
Actina: si tratta di una proteina globulare che nel citoplasma polimerizza a formare filamenti a due catene avvolte l'una sull'altra. Forma i filamenti sottili assieme alla troponina e alla tropomiosina.
Tropomiosina: si tratta di una molecola filamentosa, con una struttura a bastoncino. È costituita da due alfa eliche unite fra loro da un ponte disolfuro in una superelica. I filamenti di tropomiosina si inseriscono nel solco creato dai filamenti di actina su entrambi i lati. Una molecola di tropomiosina è legata a 7 molecole di f-actina.
Troponina: si tratta di una molecola globulare, costituita da 3 subunità:
Tp C: lega il Ca, dando inizio al processo contrattile;
Tp I: lega il complesso troponinico all'actina;
Tp T: lega il complesso troponinico alla tropomiosina.
Titina: singole molecole di titina sono in parte comprese nel filamento spesso, per il quale assolvono la funzione di stampo; la parte restante unisce il filamento spesso agli elementi trasversali del citoscheletro ed è molto elastica (cambia dimensioni con il sarcomero).
Nebulina: si tratta di una proteina di scoperta relativamente recente, difficile da estrarre per la sua lunghezza (1,05 micron). La sua funzione è quella di imporre ai filamenti di F-actina una dimensione standard (circa un micrometro). I filamenti di actina, infatti, non sono codificati dal genoma, ma interviene la nebulina, che funge da stampo all'elica in formazione. Altre proteine presenti all'estremità della molecola di nebulina impediscono una ulteriore polimerizzazione della G-actina. Non è presente nel muscolo liscio ed in quello cardiaco.
Altre proteine hanno la funzione di ancorare i filamenti alla matrice extracellulare, mettendo in contatto la macchina contrattile con le fibre adiacenti. Fra queste proteine ricordiamo la distrofina, le cui alterazioni genetiche causano le patologie note come distrofie.
Sarcomero figura
Meccanismo della contrazione muscolare
L'interazione fra actina e miosina, che si associa con l'idrolisi di ATP, rappresenta il processo fondamentale di trasduzione chemiomeccanica mediante il quale nel muscolo l'energia chimica è convertita in energia meccanica.
La miosina agisce come ATPasi e può catalizzare l'idrolisi di ATP in ADP e Pi. L'ATP si lega al suo sito, una sorta di fessura nella testa della miosina, e viene idrolizzato istantaneamente. Il complesso miosina-ADP-Pi ha un'alta affinità per l'actina, che si lega formando il composto actomiosina. A questo punto la testa di miosina rilascia il Pi e modifica la sua conformazione: la tasca di chiude e tutta la parte globulare si distorce. Il ponte trasversale passa da un orientamento perpendicolare (90°) rispetto ai filamenti di actina ad un angolo di circa 45° (colpo di forza). Il complesso actomiosinico passa così ad uno stato energetico più basso, con una maggiore affinità per l'ATP. Quando lega ATP, diminuisce l'affinità fra l'actina e la miosina e i due filamenti si dissociano. La miosina a questo punto idrolizza ATP in ADP e Pi ed il processo è pronto a riprendere.
Lo spostamento prodotto è nell'ordine di 10 nm; ciascun filamento contiene circa 500 teste di miosina e ciascuna di queste può compiere fino a 5 cicli/s durante una contrazione rapida.
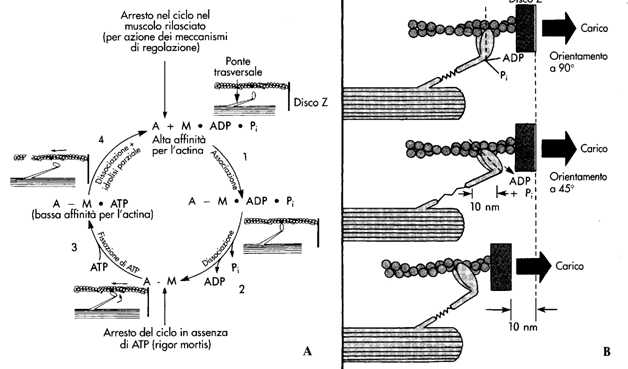
Metabolismo energetico muscolare
La contrazione muscolare richiede ATP per:
attività ATPasica della miosina;
pompa del Ca nel reticolo sarcoplasmatico;
pompe ioniche, pompa Na / K
Le fonti di ATP sono:
fosforilazione diretta, grazie alla fosofcreatina. A riposo, una gran parte delle molecole di ATP cedono un gruppo fosforico alla fosfocreatina, ricostituendone le riserve. Durante l'esercizio fisico, le molecole di fosfocreatina vengono idrolizzate fra le teste delle miosina e dell'actina e cedono il fosfato all'ADP, ricostituendo ATP. La concentrazione plasmatica di fosfocreatina è ridotta e così questo meccanismo può essere utilizzato solo per sforzi brevi.
fosforilazione ossidativa, processo molto efficace, che tuttavia richiede un adeguato apporto di ossigeno. Inoltre si tratta di un processo piuttosto lento che non è in grado di soddisfare la capacità di consumo di ATP delle cellule muscolari scheletriche che si contraggono rapidamente.
glicolisi, processo in cui il glucosio intracellulare viene degradato a piruvato o a lattato. Se è presente O2 viene degradato a piruvato, con produzione di 2 molecole di ATP. Il piruvato entra poi nel ciclo di Krebs e metabolizzato a CO2 e H2O. In condizioni anaerobiche il glucosio presente viene degradato a lattato, con due svantaggi: il lattato non entra nel ciclo di Krebs (produzione minore di ATP) ed è un composto difficile da smaltire (a differenza di CO2 e H2O). La contrazione procede fino a che non si esauriscono le riserve di glicogeno (polimero del glucosio) o sopravviene l'acidosi (la quantità di lattato supera la capacità tamponante del tessuto e la concentrazione di H aumenta fino ad inibire gli enzimi).
L'utilizzo della glicolisi anaerobica porta a contrarre un debito di ossigeno: al termine dell'esercizio fisico è necessaria una quantità supplementare di ossigeno per ripristinare le riserve di ATP e fosfocreatina e rimuovere l'eccesso di lattato. Il debito di ossigeno può essere calcolato misurando il consumo di ossigeno al termine dell'esercizio, fino al raggiungimento di un valore basale costante e sottraendo al consumo totale tale valore.
Accoppiamento eccitazione contrazione
Giunzione neuromuscolare. Ecco quali sono gli eventi che portano dal potenziale lungo il nervo al potenziale lungo la membrana cellulare muscolare. Ricordiamo che la giunzione neuromuscolare non ha capacità integrative, per cui si ha una risposta di tipo uno ad uno: ad ogni potenziale d'azione che arriva al bottone sinaptico si ha un potenziale di membrana.
1) apertura dei canali del Ca voltaggio sensibili del bottone;
2) rilascio di vescicole di acetilcolina;
3) legame con i recettori posti sulle pieghe giunzionali;
4) apertura canali Na e K
5) ingresso di Na (a riposo la forza che tende a far entrare il Na è maggiore di quella che estrude K)
6) depolarizzazione: potenziale d'azione che parte ai due lati della placca motrice
Passaggio del segnale dalla membrana cellulare al reticolo sarcoplasmatico
Il potenziale d'azione entra nei tubuli T, che permettono di propagarlo a tutta la cellula (altrimenti il potenziale d'azione raggiungerebbe solo le miofibrille più esterne). I tubuli T sono in stretto rapporto con le cisterne terminali del reticolo sarcoplasmatico, a cui sono collegate da strutture proteiche, i piedi. Sulla membrana dei tubuli T sono presenti i recettori per la diidropiridina, canali del Ca voltaggio sensibili. Questi canali si aprono in seguito all'arrivo del potenziale d'azione solo nel cuore e l'ingresso di Ca extracellulare favorisce l'uscita del Ca immagazzinato nel reticolo sarcoplasmatico. Nel muscolo scheletrico, invece, all'arrivo del potenziale d'azione il recettore per la diidropiridina cambia di conformazione e spinge meccanicamente il piede, che apre un canale per il Ca del reticolo sarcoplasmatico, il recettore per la rianodina[2]. Il Ca esce così dal reticolo sarcoplasmatico secondo gradiente e causa la contrazione muscolare:
1) il Ca si lega alla subunità C della troponina;
2) la tropomiosina si sposta nella profondità del solco di actina, lasciando liberi i siti di legame per la miosina;
3) actina e miosina si legano;
4) la testa di miosina rilascia il Pi;
5) cambiamento conformazionale e contrazione.
Il rilasciamento muscolare avviene grazie ad una pompa Ca-Mg-ATPasi che riporta il Ca all'interno del reticolo sarcoplasmatico contro il gradiente di concentrazione. La diminuzione della concentrazione intracellulare di Ca porta la tropomiosina a coprire i siti di legame presenti sull'actina per la miosina. L'ingombro sterico costituito dalla tropomiosina impedisce un'ulteriore contrazione (rilasciamento).
Meccanica muscolare
Tipi di contrazione
contrazione isometrica: il muscolo si contrae a lunghezza costante, sviluppando forza. Questo tipo di contrazione non produce lavoro fisico ed è importante per il mantenimento della postura.
grafico
contrazione isotonica: il muscolo si contrae a carico costante, sviluppa forza ed accorciamento. La contrazione isotonica a carico zero è una condizione che si verifica solo sperimentalmente, poiché in vivo il muscolo muove sempre delle strutture ossee ed articolari. Questo tipo di contrazione non sviluppa forza ma solo accorciamento.
grafico
contrazione eccentrica: si tratta di una contrazione contro una forza superiore alla massima forza isometrica. Produce sviluppo di forza ed allungamento muscolare. Si tratta del tipo di contrazione che viene attuata per spostare un grosso carico da un piano elevato al pavimento: non si riesce a sollevare il peso, ma a spostarlo sul pavimento sì. Viene sviluppata una forza superiore alla massima forza isometrica; inoltre vengono prodotti dei piccoli danni a livello cellulare che stimolano l'ipertrofia muscolare. I filamenti di actina vengono "strappati" alle teste di miosina che vi si riagganciano senza utilizzare ATP.
grafico
Relazione tensione-lunghezza. Il muscolo a riposo, se allungato, tende a sviluppare una forza che lo riporti alle dimensioni iniziali: il muscolo tende a comportarsi come un corpo elastico, sviluppando cioè una tensione passiva[3]. Si può studiare questo fenomeno isolando un muscolo da un animale da esperimento e applicando alle sue due estremità una vite micrometrica (per fissarne la lunghezza) ed un trasduttore di forza (per misurare la forza). Si misura la forza per lunghezze diverse; inoltre si può far contrarre il muscolo e calcolare così la tensione totale, ossia la somma della tensione passiva e della tensione attiva (forza contrattile del muscolo). La tensione attiva può essere calcolata sottraendo dalla tensione totale la tensione passiva.
La forza varia con le dimensioni del muscolo e per consentire paragoni con altri tessuti viene espressa come tensione (forza/area della sezione trasversale del muscolo). Riportando in un diagramma le tensioni attiva, passiva, totale e la lunghezza del muscolo si ottiene il grafico tensione lunghezza:
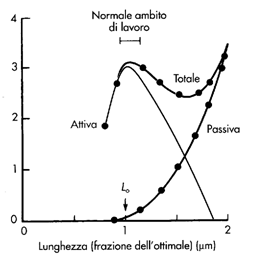
come si vede il normale ambito di lavoro coincide con la massima
tensione attiva, mentre il contributo della tensione passiva è
trascurabile. Il contributo della tensione passiva supera il contributo della
tensione attiva quando la lunghezza del muscolo è del 50% maggiore della
lunghezza di riposo. Quando la lunghezza del muscolo è il doppio della
lunghezza di riposo la tensione sviluppata, completamente passiva, supera la
tensione sviluppata nel normale ambito di lavoro.
Determinanti della forza sviluppata. La forza sviluppata da un muscolo dipende dal numero di interazioni actina-miosina che si formano nella sezione trasversa di un muscolo. La lunghezza del muscolo non influenza la forza, ma solo la velocità di accorciamento, poiché le forze dei sarcomeri in serie non si sommano. A sua volta il numero di interazioni acitna-miosina dipende da molti fattori: a livello cellulare ed a livello del muscolo in toto.
A livello cellulare
diametro della cellula
lunghezza dei sarcomeri
quantità di Ca che si lega alla troponina C
frequenza di stimolazione
tipi di miosina
A livello del muscolo in toto
numero di unità motorie attivate (size principle)
frequenza di stimolazione
distribuzione percentuale dei diversi tipi di unità motorie
architettura muscolare
Diametro della cellula: più grande è la cellula muscolare, maggiore sarà il numero di interazioni actina-miosina. Ponendo i sarcomeri in parallelo le forze si sommano, per cui un muscolo con numerosi sarcomeri in parallelo sviluppa una forza notevole.
Lunghezza dei sarcomeri: esiste una lunghezza ottimale alla quale la forza sviluppata è massima, come sappiamo dalla relazione tensione-lunghezza. Tale lunghezza corrisponde a circa 2-2,2 micron per ciascun sarcomero.
Al di sopra di tale lunghezza la sovrapposizione fra filamenti spessi (lunghi 1,6 micron) e sottili (1 micron) si riduce, fino ad arrivare al caso limite in cui non vi è più alcuna sovrapposizione (a circa 3,6 micron: nessuno sviluppo di forza).
Al di sotto del valore ottimale la forza sviluppata diminuisce per la presenza al centro del filamento spesso di una zona nuda, lunga circa 0,2 micron, in cui non esistono ponti trasversali. Inoltre già sotto i 2 micron i filamenti sottili urtano fra loro opponendo una resistenza elastica. Sotto i 1,6 micron i filamenti sottili sono intersecati fra loro e i filamenti spessi urtano contro le linee Z.
Le fibre lavorano ad una lunghezza che varia fra 1,9 e 2,4 micron. Lunghezze diverse non si hanno in vivo, ma solo in condizioni sperimentali.
Quantità di Ca che si lega alla troponina C: la quantità di Ca che si lega alla troponina C è proporzionale al numero di siti che si liberano per l'interazione actina-miosina. La quantità di calcio che si lega alla troponina C dipende da:
quantità di Ca liberata dal reticolo sarcoplasmatico;
affinità della troponina C per il Ca;
tempo in cui la [Ca] resta alta nel citoplasma.
Quest'ultimo è l'unico fattore che si modifica nel muscolo scheletrico e dipende dalla frequenza di stimolazione. Aumentando la frequenza di stimolazione, aumenta la quantità di Ca intracellulare. La forza aumenta fino ad una concentrazione massima (pCa = 4,5) oltre la quale la forza non varia ulteriormente, poiché tutte le TpC hanno legato Ca.
Frequenza di stimolazione: il potenziale d'azione ha una durata di 2-4 ms; la contrazione muscolare invece dura 10-100 ms. Potenziali d'azione successivi possono attivare la fibra muscolare prima che si sia completamente rilasciata. L'ulteriore attivazione dell'elemento contrattile si somma a quella già in corso (sommazione di contrazioni). La tensione che si sviluppa è maggiore di quella sviluppata in una singola scossa.
Con stimoli rapidamente ripetuti, prima che il muscolo cominci il rilasciamento, si ha una contrazione continua, il tetano[4]. Se vi sono periodi di incompleto rilasciamento fra una stimolazione e l'altra il fenomeno prende il nome di tetano incompleto o clono. Il tetano sviluppa una tensione che è circa quattro volte quella di una singola scossa.
Tipo di miosina: esistono tre diverse isoforme di miosina, codificate da geni diversi: 1, 2A e 2X. Le diverse isoforme sono intercambiabili nel sarcomero senza danneggiare la sua azione; hanno funzioni diverse: quelle di tipo 1 permettono una contrazione lenta; quelle di tipo 2A una contrazione intermedia, quelle di tipo 2X una contrazione veloce. L'isoforma 1 sviluppa una forza del 30% minore rispetto alle isoforme di tipo 2. La differenza nello sviluppo di forza non è molto significativa (lo è solo per gli atleti); la differenza nella velocità di accorciamento è molto superiore (può aumentare fino a 10 volte).
Determinanti della forza a livello del muscolo in toto
Numero di unità motorie attivate: nel movimento, a meno che non si tratti di uno scatto, non vengono utilizzate tutte le unità motorie: ovviamente la forza è maggiore quante più unità motorie vengono attivate.
Tipo di unità motorie: per il reclutamento sterotipato delle unità motorie (v.avanti) vengono reclutate prima le unità motorie (S), che sviluppano meno forza, in modo tale da permettere una regolazione fine della forza.
Frequenza di stimolazione: le unità motorie hanno una propria frequenza di stimolazione, per cui un aumento della frequenza permette di reclutare anche unità che in precedenza non erano attivate.
Architettura muscolare: l'orientamento dei fasci muscolari all'interno di un muscolo influisce sullo sviluppo di forza: un muscolo fusiforme trasmette tutte la forza sviluppata ai capi muscolari, mente un muscolo pennato ne trasmette solo una parte (in rapporto all'angolo di pennazione).
Determinanti della velocità di accorciamento
La velocità di accorciamento dipende essenzialmente dalla velocità dell'interazione actina-miosina. A livello cellulare i fattori che influenzano la velocità di accorciamento sono:
1) carico applicato ---> relazione forza-velocità
2) massima forza isometrica
3) velocità di scissione dell'ATP
Carico applicato e relazione forza-velocità: la velocità di accorciamento della fibra muscolare diminuisce all'aumentare del carico applicato secondo una relazione iperbolica:
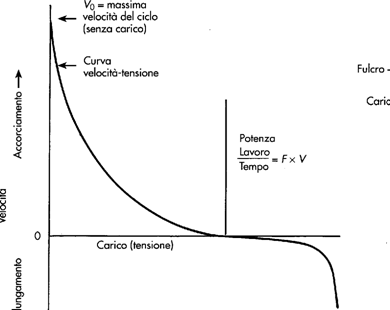
il punto P0 rappresenta il carico massimo: la fibra
non si accorcia, perché non può sollevare più della forza
isometrica. Se applichiamo un carico ancora maggiore la fibra si allunga. Per
disegnare questa curva si collegano carichi sempre più grandi alla fibra
e si calcola la variazione di lunghezza con un trasduttore di lunghezza.
Massima forza isometrica: la velocità di accorciamento contro un carico maggiore di zero dipende dal numero di interazioni actina-miosina (e quindi dalla forza). Un numero maggiore di interazioni actina-miosina, infatti, permette di ripartire maggiormente il carico fra le miosine e quindi lo scorrimento può essere più veloce.
Attività ATPasica della miosina: un'attività ATPasica diversa dà una velocità di accorciamento diversa. Le fibre 1 hanno una attività ATPasica 3 volte più bassa delle fibre 2; questo si traduce in una velocità di contrazione 10 volte inferiore. I muscoli contengono tutti i tipi di fibre, ma in percentuale diversa: i muscoli lenti contengono più fibre 1, i muscoli veloci più fibre 2.
A livello del muscolo in toto i fattori che aumentano la velocità di accorciamento sono:
1) tipo di unità motoria attivata
2) numero di unità motorie attivate
3) architettura muscolare
Tipo di unità motorie attivate: per il reclutamento stereotipato vengono prima attivate le unità motorie S, più lente, poi quelle FR e FF, più veloci. Inoltre la diversa composizione percentuale di fibre fa variare da muscolo a muscolo la velocità di accorciamento.
Numero di unità motorie attivate: maggiore è il numero di unità attivate, maggiore è la forza sviluppata. Più forza sviluppata vuol dire che vi sono più interazioni actina-miosina, per cui è possibile distribuire di più il carico ed aumentare la velocità di accorciamento.
Architettura muscolare: mentre in un muscolo fusiforme tutto l'accorciamento di una fibra serve per avvicinare i due tendini, in un muscolo pennato l'angolo di pennazione fa diminuire l'accorciamento del muscolo a parità dell'accorciamento della fibra. La velocità di accorciamento è tanto maggiore quanto maggiore è l'angolo di pennazione.
Tipi di fibre muscolari scheletriche
I , lente
II A, intermedie
II X, veloci
le fibre II B si trovano solo negli animali da esperimento (cavie); questo gene nell'uomo è silente.
Unità motorie, classificazione
L'unità
motoria è formata dal motoneurone alfa e da tutte le fibrocellule
muscolari da esso innervate. Il numero di fibre può variare da 3-
Le unità motorie vennero classificate da Burke in:
FF (fast fatigue): unità motorie veloci che si affaticano rapidamente;
FR (fatigue resistant): unità motorie meno veloci che si affaticano più lentamente;
S (slow fatigue resistant): unità motorie lente ma resistenti alla fatica
Le caratteristiche delle unità motorie dipendono dalle fibre in esse contenute: ovviamente
2X ----> FF
2A ----> FR
1 ---> S
Le fibre vengono classificate secondo la loro sensibilità alla fatica: vengono stimolate con tetani di 0,33 secondi ogni secondo per due minuti, dopodiché si controlla l'indice di fatica (rapporto forza dopo 2 minuti/forza iniziale) e l'aspetto del tetano (presenza o meno del "sag", caduta delle forza che si sviluppa nelle fibre FR).
Tetani
Le unità S non si affaticano (indice di fatica = 1);
Le unità FR non si affaticano ma sviluppano un tetano incompleto (sag);
Le unità FF si stancano facilmente (indice di fatica = 0,1) ma sviluppano una forza molto maggiore rispetto ad S.
Tabella di paragone fra unità S ed FF
|
proprietà |
S |
FF |
|
Numero di fibre |
basso |
alto |
|
Faticabilità |
bassa |
alta |
|
Sviluppo di forza |
lento |
rapido |
|
Forza massima |
bassa |
alta |
|
Attività ATPasica |
bassa |
alta |
|
Velocità di accorciamento |
bassa |
alta |
|
Metabolismo |
aerobico |
anaerobico |
|
Concentrazione enzimi glicolitici |
bassa |
alta |
|
Concentrazione enzimi ossidativi |
alta |
bassa |
|
Concentrazione glicogeno |
bassa |
alta |
|
Concentrazione mitocondri |
alta |
bassa |
|
Prodotto di scarto |
CO2 |
acido lattico |
|
Densità di capillari |
alta |
bassa |
|
Tipo cellulare |
1 (rosse) |
2X (bianche) |
|
Diametro assone |
piccolo |
grande |
|
Numero terminazioni |
basso |
alto |
|
Motoneurone |
piccolo |
grande |
Reclutamento stereotipato
L'attivazione delle unità motorie avviene secondo un ordine ben preciso (size principle), stereotipato.
Vengono attivate dapprima unità S, che:
sviluppano poca forza;
si accorciano lentamente;
resistono alla fatica.
Vengono poi attivate via via unità FR e FF che sono:
più forti
più veloci
meno resistenti alla fatica.
Gli scopi del reclutamento stereotipato sono i seguenti:
regolazione fine della forza sviluppata (le prime unità motorie attivate sono più deboli rispetto alle successive)
regolazione della velocità di accorciamento e della potenza muscolare (si reclutano via via unità più veloci)
ottimizzazione del consumo di energia (le fibre 1 sono più economiche rispetto alle 2)
ottimizzazione della fatica (le prime fibre reclutate sono le meno affaticabili)
Il SNC non conosce a quale unità motoria è collegato il motoneurone; un controllo del genere sarebbe molto dispendioso. Il controllo è molto più semplice e si basa su una semplificazione anatomica: i motoneuroni che innervano le unità S sono più piccoli e quindi più eccitabili. Il controllo nervoso invia un segnale uguale a tutti i motoneuroni alfa; lo stesso segnale può far scaricare i neuroni più piccoli e non quelli più grandi. Questo fenomeno può essere alla base dello sviluppo del tono muscolare scheletrico: una frequenza di stimolazione bassa può far attivare solo le fibre S responsabili del tono. Un aumento della frequenza di scarica attiva via via più unità motorie, con conseguente aumento della forza. Inoltre, vengono attivate unità motorie sempre più veloci, con aumento della velocità e della potenza.
Muscolo liscio
Il muscolo liscio si trova:
vie aeree (parete bronchiale di cui determina il calibro)
sistema vascolare (determina la resistenza dei vasi)
sistema digerente (tonaca muscolare del canale alimentare: funzione peristaltica e di serbatoio)
apparato urinario
occhio (mm. ciliare, costrittore dell'iride e dilatatore dell'iride)
utero
Le sue funzioni sono più eterogenee rispetto a quelle degli altri muscoli:
promuove la motilità di un organo e/o ne modifica la forma (contrazioni fasiche della vescica, del canale alimentare)
preserva le dimensioni di un organo (contrazioni toniche, come nel sistema vascolare)
Morfologia funzionale
Il muscolo liscio non si inserisce sullo scheletro, a differenza del muscolo scheletrico. Nel muscolo scheletrico le cellule sono in parallelo e non necessitano di connessioni: una sola unità motoria è in grado di sviluppare una forza. Nel muscolo liscio le cellule sono alcune in serie, altre in parallelo: si necessita un'alta coordinazione funzionale, poiché la contrazione di unità motorie isolate porterebbe allo stiramento di alcune fibre e all'allungamento di altre. Tale efficace coordinazione motoria viene raggiunta grazie al sistema di controllo nervoso, al sistema di controllo ormonale ed alla presenza di connessioni intercellulari che garantiscono una connessione meccanica, oltre che il passaggio di ioni.
Esistono diversi tipi di classificazione a causa dell'eterogeneità del muscolo liscio: alcuni autori li distinguono in multiunitari ed unitari. I muscoli lisci multiunitari
non hanno gap junctions;
necessitano un controllo più stretto da parte del SNA per fa contrarre coordinatamente le cellule in serie;
devono essere stimolati da terminazioni nervose o da ormoni;
non hanno potenziale d'azione, ma solo Vm variabile;
si trovano nell'iride, nei vasi e negli sfinteri;
non sono dei sincizi funzionali.
I muscoli lisci unitari
hanno tutte le cellule accoppiate elettronicamente e meccanicamente;
sono innervati, ma si contraggono anche in assenza di innervazione;
hanno contrazioni spontanee e autoritmicità (cellule pacemaker);
hanno un potenziale d'azione che si propaga da cellula a cellula;
si trovano nel tubo gastroenterico.
Un'altra classificazione distingue i muscoli lisci in fasici e tonici. I muscoli lisci fasici si contraggono in modo intermittente o ritmico, le cellule hanno un potenziale d'azione. Si trovano nell'apparato gastroenterico e nell'apparato urogenitale. I muscoli lisci tonici sono continuamente attivi (con livelli maggiori o minori di tonicità); tali cellule non hanno un potenziale d'azione, ma solo Vm variabile. Si trovano nelle vie aeree, nei vasi sanguigni, negli sfinteri. Bisogna tuttavia ricordare che tutte le cellule muscolari lisce sono capaci di comportamenti sia tonici, sia fasici.
Struttura delle cellule muscolari lisce. Le cellule muscolari lisce sono mononucleate (alcuni ritengono che in caso di ipertrofia si abbia un aumento del corredo cromosomico). Sono lunghe 50-500 micron e hanno un diametro di 2-5 micron. Il loro potenziale di membrana oscilla fra 40-60 mV. Nel muscolo liscio mancano i tubuli a T, sostituiti dalle caveole, invaginazioni della membrana plasmatica poco profonde, che permettono di aumentare la superficie. Il reticolo sarcoplasmatico è poco sviluppato.
L'apparato contrattile mostra numerose differenze, in confronto alla cellula muscolare scheletrica. Poiché il muscolo liscio deve operare in configurazioni non lineari, al microscopio elettronico non appare quella disposizione ordinata che caratterizza il muscolo striato.
Nelle cellule muscolari lisce il citoscheletro serve per ancorare i filamenti sottili e per trasmettere la forza ai due capi della cellula. L'equivalente funzionale delle linee Z è rappresentato dai corpi densi, di forma ellissoidale e situati nella regione centrale della cellula, e dalle aree dense, disposte lungo il sarcolemma. Queste strutture fungono da attacco per i filamenti sottili e contengono alfa actinina, come le linee Z del muscolo striato. Nel muscolo liscio sono presenti in abbondanza filamenti intermedi, di diametro intermedio fra i filamenti sottili e i filamenti spessi. La loro funzione è quella di connettere fra loro i corpi e le aree dense, formando così la rete del citoscheletro. Tutti i muscoli lisci contengono filamenti intermedi, costituiti da desmina e talvolta anche vimentina.
L'organizzazione dei filamenti contrattili è poco nota. I filamenti sottili sono presenti in quantità doppia rispetto al muscolo striato; sono formati da actina e tropomiosina, ma mancano della troponina. In più hanno due proteine la cui funzione non sembra essere fondamentale: il caldesmone e la calponina. I filamenti spessi sono presenti in numero quattro volte minore rispetto al muscolo scheletrico (ma la forza sviluppata è la stessa, nonostante la minore quantità di miosina).
Piccoli gruppi di 3-5 filamenti spessi sono interdigitati con filamenti sottili. Questi ultimi sono ancorati alle aree dense: sembra che queste strutture rappresentino gli equivalenti dei sarcomeri. Le aree dense di membrane adiacenti sono connesse tra loro, rendendo impossibile il funzionamento isolato di una fibrocellula.
Funzione contrattile
Relazione tensione-lunghezza. Nel muscolo liscio sono presenti fibrille di elastina e di collagene. Analoghi della titina sono i corpi densi, collegati fra loro dai filamenti intermedi. Queste strutture assicurano al muscolo liscio una tensione passiva che contrasta lo stiramento delle fibre. La curva tensione-lunghezza è simile qualitativamente a quella analoga del muscolo striato, anche se vi sono delle differenze quantitative.
La forza attiva sviluppata è simile a quella del muscolo scheletrico, nonostante il contenuto in miosina di circa 1/4. Non si tratta di una maggiore tensione attiva sviluppata dai ponti del muscolo liscio: la differenza rispetto al muscolo striato è che questi ponti hanno un ciclo più lento e rimangono attaccati per più tempo.
Relazione forza-velocità. È qualitativamente simile a quella del muscolo scheletrico (ha una forma iperbolica), ma la velocità di accorciamento è molto minore che nel muscolo scheletrico. A differenza della curva forza velocità del muscolo scheletrico, che dipende solo dal carico e dall'isoforma di miosina, la curva forza-velocità del muscolo liscio dipende anche dalla fosforilazione Ca-dipendente delle fibre di miosina. Variando il grado di fosforilazione, si ottengono delle famiglie di curve forza-velocità. Ovviamente, maggiore è la fosforilazione, maggiore è il numero di ponti actina miosina che si formano e quindi l'accorciamento sarà di conseguenza più veloce.
Accoppiamento eccitazione-contrazione
Sequenza di eventi della contrazione
1) aumento di [Ca] nel citoplasma (o da canali del sarcolemma - Ca extracellulare - o dal reticolo sarcoplasmatico - Ca intracellulare)
2) legame Ca-calmodulina (4 Ca su siti di legame ad alta affinità)
3) legame Ca-calmodulina con miosina chinasi
4) attivazione della miosina chinasi
5) fosforilazione delle catene leggere regolatorie della miosina
6) attivazione dell'interazione actina-miosina e dell'idrolisi dell'ATP da parte della miosina
7) interazione actina-miosina
8) contrazione: sviluppo di forza sino all'intervento della miosina fosfatasi
La miosina fosfatasi può intervenire in qualsiasi momento del ciclo, rallentando la velocità dei cicli. Per l'attacco actina-miosina è necessaria la fosforilazione. Si noti che l'ATP è richiesto sia per i cicli di contrazione, sia per la regolazione.
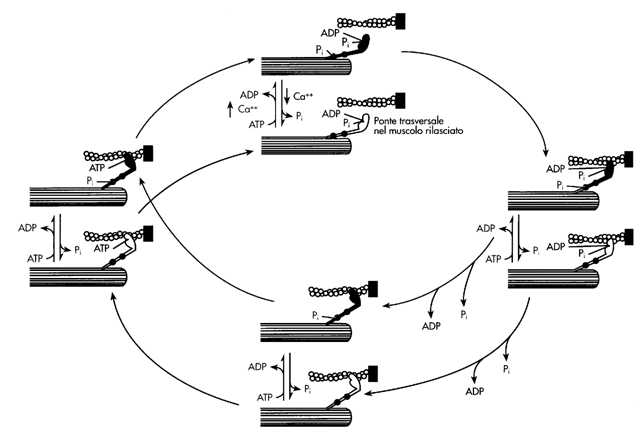
Rilasciamento
1) la [Ca] citoplasmatica diminuisce
2) la defosforilazione (non regolata) prevale sulla fosforilazione
3) inibizione interazione actina miosina ed attività ATPasica miosina
Il muscolo liscio è molto più lento ma più economico del muscolo striato. Se la miosina viene defosforilata quando è legata all'actina, resta legata ad essa dopo aver esaurito il suo colpo di forza. Questa condizione, che nel muscolo scheletrico sarebbe poco vantaggiosa ("c'è un rematore che frena") impedisce lo stiramento senza alcun consumo di ATP. Questo fatto rende il muscolo liscio più economico, benchè ci sia bisogno di ATP per l'attivazione della miosina (mentre il legame Ca-TpC non richiede ATP)
Regolazione della concentrazione intracellulare di Ca
I compartimenti contenenti calcio sono due:
extracellulare (regolato dal sarcolemma)
intracellulare (regolato dal reticolo sarcoplasmatico)
Il reticolo sarcoplasmatico
non risponde direttamente alla depolarizzazione del sarcolemma, ma al legame con recettori specifici di membrana di
neurotrasmettitori (SNA)
ormoni (il messaggero intracellulare è l'IP3)
risponde all'aumento della [Ca] citoplasmatica
in seguito all'apertura di canali di membrana
Il sarcolemma è dotato di due diverse categorie di canali per il Ca:
voltaggio dipendenti (si aprono per depolarizzazione della membrana)
ligando dipendenti (causano contrazioni senza modifiche del Vm: accoppiamento farmaco-meccanico)
Il recupero di Ca avviene grazie ad una pompa Ca-ATPasica e ad uno scambiatore Na/Ca (3:1)
Metabolismo energetico
Le necessità metaboliche del muscolo liscio durante la contrazione sono facilmente soddisfatte dalla fosforilazione ossidativa, in quanto le velocità di consumo sono basse. La fatica non si verifica a meno che la circolazione non sia bloccata. Anche quando l'ossigeno è liberamente disponibile la glicolisi aerobica riesce di norma ad alimentare le pompe di membrana.
Sistemi di controllo dell'attività contrattile
innervazione
estrinseca (SNA)
intrinseca (plessi di Auerbach e Meissner)
ormoni e sostanze chimiche liberate localmente
cellule endoteliali (mediano l'azione di alcuni ormoni e farmaci: l'endotelio non è un filtro passivo)
intrinseco (cellule pacemaker: presenti solo nel muscolo unitario)
[1] Si deve comunque sottolineare che il numero di ioni responsabili del potenziale di membrana è una minima frazione del numero totale presente, e che la concentrazione totale di ioni positivi e negativi è uguale dovunque, eccetto che lungo la membrana.
[2] La diidropiridina e la rianodina sono due sostanze esogene che bloccano i due recettori (la rianodina in posizione di apertura)
[3] La proteina titina è responsabile dello sviluppo di questa tensione passiva
[4] Ciò non può accadere nel muscolo scheletrico, dove il potenziale d'azione è di circa 250 ms, che rende refrattario il muscolo scheletrico ad altri stimoli.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2026