|
|
| |
DECOLORAZIONE DEL GEL E COLORAZIONE DEL FILTRO DOPO IL TRASFERIMENTO
OBIETTIVO
Decolorare il gel nella soluzione di blu comassie e determinare il peso molecolare della proteina espressa sul gel.
PROCEDIMENTO:
precedentemente abbiamo preparato 250 ml di sol 131h78b uzione per la decolorazione del gel elettroforetico contenenti:25% di metanolo
7% di acido acetico
Metanolo : 250 ml x 0,25 = 62,5 ml
Acido acetico : 250 ml x 0,07 = 17,5 ml
H2o : 170 ml
Fatto ciò abbiamo messo la soluzione in una bottiglia di vetro e l’abbiamo lasciata riposare.
Dopo aver eliminato bene la soluzione di blu comassie , abbiamo versato al soluzione decolorante, e l’abbiamo agitata per circa 5-10 minuti. Fatto ciò si eliminava la soluzione e la si cambiava ogni volta, il tutto per circa tre volte finchè il gel non era ben decolorato.
Contemporaneamente abbiamo colorato la membrana di PVDF con rosso ponceau che si lega ai gruppi amminici delle proteine.
Osservando il nostro gel , saremmo dovuti arrivare a costruire una curva di calibrazione, usando carta millimetrata e in tal modo determinare il peso molecolare della proteina incognita.
Sull’asse delle ascisse abbiamo messo le distanze in cm tra una banda e l’altra, mentre sull’asse delle ordinate il logaritmo del peso molecolare.
|
Peso molecolare |
Log peso molecolare |
Distanze in cm |
|
170 |
2.23 |
1.1 |
|
130 |
2.11 |
1.4 |
|
95 |
1.98 |
1.8 |
|
72 |
1.86 |
2.2 |
|
55 |
1.74 |
2.7 |
|
43 |
1.63 |
3.2 |
|
34 |
1.53 |
3.7 |
|
26 |
1.41 |
4.3 |
|
17 |
1.23 |
5.2 |
|
11 |
1.04 |
5.8 |
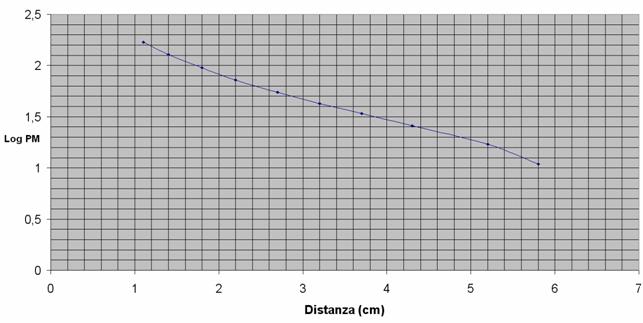
Infine non siamo riusciti a ricavare il peso della proteina, in quanto sul gel dell’elettroforesi non sono comparse le 10 bande ma solo 6, quindi non le abbiamo potute riportare sul grafico ed inoltre sono comparsi degli aloni troppo grandi, poiché molto probabilmente abbiamo non abbiamo diluito in modo corretto.
|
Privacy |
Articolo informazione
Commentare questo articolo:Non sei registratoDevi essere registrato per commentare ISCRIVITI |
Copiare il codice nella pagina web del tuo sito. |
Copyright InfTub.com 2026